Brachinus crepitans, El Escarabajo Bombardero.
(Edited)

Autor: @madridbg
Bienvenidos a todos aquellos lectores de la comunidad de Hive, en esta entrega estaremos hablando sobre lo maravillosa que tiende hacer la química, aplicada a la naturaleza. Por consiguiente, analizaremos a detalle los mecanismos de defensa que utilizan los escarabajos bombarderos (Brachinus crepitans), el cual está asociado a los principios de la termoquímica.
INTRODUCCIÓN
La sociedad del hoy, ha permanecido intactas debido a los diferentes mecanismos de defensa y evolución que ha logrado desarrollar, de igual manera los sistemas bióticos del planeta de alguna forma han logrado mantenerse en equilibrio, a pesar de los cambios abrumante que ha generado el hombre en su entorno.
En la actualidad, podemos observar especie que han mutado o se han adaptado al medio utilizando mecanismos o técnicas de defensa para su supervivencia, un ejemplo de ello son los camaleones, los cuales han logrado cambiar la pigmentación de su piel para confundir a los posibles depredadores, de igual forma las mariposas Limenitis que han conseguido replicar el olor y desagradable sabor de las mariposas monarcas Danaus lo que les ha permitido perdurar en ambientes ferozmente competitivos, donde la supervivencia del más fuerte es la que prevalece.
El escarabajo bombardero de nombre científico Brachinus crepitans , no se ha quedado atrás, el mismo ha desarrollado una técnica sorprendente para su supervivencia que involucra reacciones químicas catalizas por enzimas con altos niveles de entalpia. Conceptos que desarrollaremos lo largo de esta publicación.
De igual forma, para instruir al lector en los principios termoquímicos abordaremos los diferentes cambios de energía que pueden ocurrir en una reacción química y fundamentaremos el efecto aerosol como arma química que ha logrado desarrollar el escarabajo bombardero.
REACCIONES QUIMICAS Y SUS CAMBIOS DE ENERGIA
Como se ha mencionado en publicaciones anteriores, una reacción química es el proceso que se produce cuando un conjunto reactivos interaccionan o reaccionan para forma nuevas sustancias (productos) con características diferentes a la de los compuestos de partidas.
Por consiguiente, es de esperarse que en las reacciones químicas se presente absorción o liberación de energía que en general tiende a ser en forma de calor, entiéndase este como la trasferencia de energía térmica entre dos cuerpos que están a diferentes temperaturas [2].
En tal sentido, a modo de instruir al lector sobre el funcionamiento del calor de las reacciones químicas se hace necesario conocer algunos conceptos asociados a la termoquímica, entiéndase como el estudio de las variaciones o cambios de calor en los procesos químicos que involucran reacciones. [4]
Al hablar de termoquímica, es resaltante hablar de sistema o parte del universo que será objeto de estudio, los sistemas lo podemos clasificar en sistemas abiertos (A), cuando existe un intercambio de masa y energía en forma de calor, por ejemplo si colocamos a hervir una olla con agua observamos que los vapores del agua entran en contactos con su entorno.
Por su parte, un sistema cerrado (B), permite la transferencia de calor a través de las paredes del recipiente pero no de masa, por ejemplo una olla de presión que no tenga orificio de salida de vapor de agua. Por último, pero no menos importante tenemos los sistemas aislados (C) que impide la trasferencia de calor y de masa, por ejemplo un recipiente recubierto al vacío.

Autor: @madridbg
Si analizamos lo ocurrido en los tres sistemas, podemos determinar que la energía que se pierde en forma de calor en los sistemas A y B la gana el entorno, lo que representa un proceso exotérmico, donde el sistema ha cedido calor a sus alrededor, por ende químicamente la energía total de los productos tiende hacer menor que la energía de los reactivos.
En contra parte, se encuentran los proceso endotérmicos, es aquí donde el sistema absorbe energía del entorno, y la variación de temperatura entre reactivos y productos depende de la cantidad de energía que se absorba.
En correspondencia con los conceptos estudiados podemos establecer que están estrechamente relacionados con la primera Ley de la termodinámica , la cual establece que la energía se puede convertir de una forma a otra, pero no se puede crear ni destruir. [4].
ENTALPIA DE LAS REACCIONES Y LA LEY DE HESS
En término entalpia, hace referencia a la relación que existe entre la energía interna de un sistema con la presión y el volumen de dicho sistema, tomando en cuenta que las reacciones química se desarrolla a presiones constantes, de acuerdo a la siguiente ecuación:
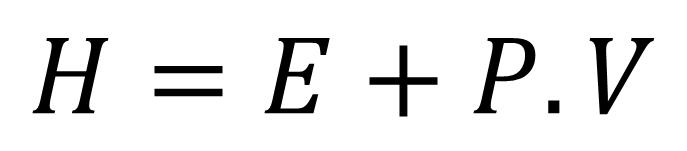
Donde H, representa la entalpia, E, la energía interna del sistema, P y V, la presión y el volumen respetivamente de dicho sistema. Ahora bien, en función de instruir al lector sobre la Ley de Hess hablaremos de variación de la entalpia (ΔH) y la ecuación la representaremos de la siguiente forma.
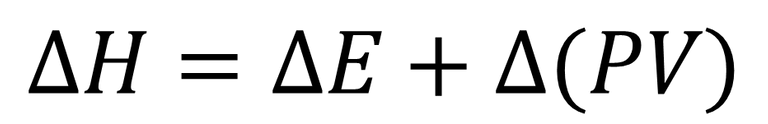
A nivel de las reacciones químicas, la variación de la entalpia puede ser negativa, cuando el proceso es endotérmico, es decir, que durante la reacción se absorbió energía del entorno, por otra parte, cuando se libera energía en forma de calor hacia el entorno, la entalpia sería positiva y estaremos al frente de una reacción exotérmica.
La variación de la entalpia en las reacciones químicas se representa de acuerdo a la siguiente ecuación.

En este punto, las ecuaciones químicas ahora se convierten en ecuaciones termoquímicas, ya que muestran tanto los cambios de entalpía como las relaciones de masa. como lo podemos observar en la siguiente ecuación.[5]
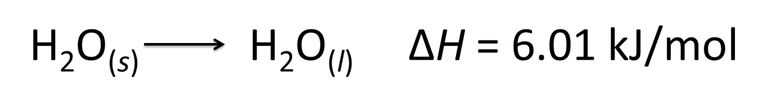
Si analizamos la ecuación, podemos extraer información relevante del fenómeno que está ocurriendo, por consiguiente se establece que un mol de hielo se está fundiendo, generando 1 mol de agua, la variación en la entalpia nos dice que durante el proceso hubo una liberación de energía al entorno (reacción o cambio exotérmico).
En referencia a la Ley de Hess, esta establece:
MECANISMO DE DEFENZA DEL ESCARABAJO BOMBARDERO
El escarabajo bombardero utiliza un mecanismo de defensa más activo que los utilizados por las mariposas Limenitis, el mismo aplica principios termoquímicos que permiten repeler a sus depredadores, utilizando una mezcla de reactivos, catalizada por enzimas, entiéndase como sustancia biológicas especializadas que aceleran la velocidad de las reacciones, logrando producir en su interior un gran nivel de entalpia, generando calores de reacción por encima de los 100°C, que luego expulsa hacia su agresor en forma de aerosol químico y estallidos audibles.
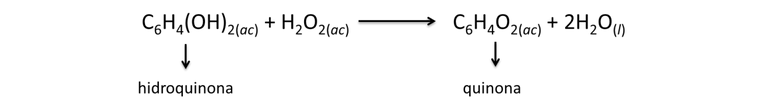
Estructuralmente el Brachinus crepitans, cuenta dos tipos de glándulas y con cuatro compartimentos en su abdomen. El compartimento interno, está compuesto por una solución de hidroquinona y peróxido de hidrogeno y en el compartimiento externo están las enzimas lista para que se desarrolle la reacción, de acuerdo a las siguiente ecuación.
“Cuando los reactivos se convierten en productos, el cambio de entalpía es el mismo independientemente de que se efectúe la reacción en un paso o en una serie de pasos”.[2].En otras palabras, si durante una reacción se producen sustancia intermediarias, la variación de la entalpia será igual a la sumatoria de todas las sustancias involucradas.

Autor: @madridbg
Al estudiar la reacción de formación de quinona, a partir de hidroquinona, se liberan una gran cantidad de energía de acuerdo a la Ley de Hess de 204 KJ/mol. La cantidad de calor generada permite llevar la mezcla en el abdomen del escarabajo al punto de ebullición (100°C) y cuando se siente amenazado lo descarga en forma de vapor, además las quinonas actúan como repelente de insectos y animales. En algunas ranas logran que estas regurgiten (vomiten), debido a que le muestran su potencial químico una vez han sido tragados, detalle que podemos ver en el siguiente material audiovisual producidos por National Geographic España.
[5] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

0
0
0.000
https://twitter.com/BGMadrid/status/1300117803807145985?s=20
Saludos @madridbg. Interesante la información. Abrazos
Gracias @siondaba, por tu valoración positiva. Saludos
Interesante artículo amigo @madridbg, de verdad que es muy gratificante leer este mecanismo de defensa explicado desde el punto de vista químico. Sin lugar a dudas la naturaleza es una caja de sorpresas, no he tenido la oportunidad de toparme con un coleóptero especializado del calibre de la especie Brachinus crepitans que describes en parte en el presente post, pero como estudioso del área, no paro de sorprenderle con las grandes herramientas que la evolución les ha otorgado a muchos artrópodos para defenderse de sus depredadores.
La capacidad defensiva de este insecto me hizo recordar a la especie Colobopsis saundersi, una es pecie de formicido (hormiga) que tiene la capacidad de explotar tras sentirse amenazada y esparcir una sustancia ácida sobre sus agresores, razón por la que la apodan como "hormiga kamikaze". Te felicito por este curioso e interesante artículo sobre este coleóptero, saludos.
Gracias @abneagro por tus palabras, es gratificante tener una valoración positiva de un especialista en el área. Para mi también fue una sorpresa cuando me conseguí el vídeo que muestro en la publicación. Por eso la necesidad de fundamentar el comportamiento desde el punto de vista de la química que es mi área de fortaleza y para mi sorpresa hay una variedad de tópicos asociados a la termo-quimica en este mecanismo de defensa que ha desarrollado el bombardero. Saludos
Hola @madridbg.
Termodinámica con química, una asociación muy interesante, ademas que al parecer la biología no queda atrás en este post. un artículo muy completo y con imagenes propias muy interesantes en la forma en cómo la trabajaste hermano. Saludos y gracias por compartir.
Gracias @carlos84 por tu palabras, es grato saber que el contenido publicado es aceptado y valorado positivamente. Saludos
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for including @stemsocial as a beneficiary, which gives you stronger support. Using the STEMsocial app could yield even more supporti next time.
Gracias @steemstem, por el apoyo prestado a los contenidos científicos y por valorar positivamente mi publicación. Saludos
Congratulations @madridbg! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board And compare to others on the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPTo support your work, I also upvoted your post!
Do not miss the last post from @hivebuzz:
Gracias @hivebuzz, por el reconocimiento otorgado a medida que avanzamos en nuestros blog. Saludos
De nada @madridbg🙂👍
¡Te agradeceríamos mucho que votaras por nuestra propuesta para que podamos seguir con el buen trabajo!
Saludos amigo @madridbg, este material es sin duda muestra como la química se pone de manifiesto en la biodiversidad, existen muchos mecanismos de defensa que muestran organismos, este sin duda es impresionante , el vídeo complementa toda la excelente explicación que realizaste. Te felicito estas haciendo un trabajo impecable, que estés bien !
Gracias @amestyj, por tu palabras. Pues como tu dice la química esta en los aspectos mas simples de nuestra cotidianidad. Te puedes imaginar lo que ocurre con los sistemas complejos. Saludos
Su post ha sido valorado por @ramonycajal
Gracias @ramonycajal por la valoración positiva en mis publicaciones, el cual me motiva a seguir trabajando por y para la comunidad.