Leyes estequiométricas
Como les comente en mi post sobre estequiometría, una reacción química es como una receta de cocina, en la cual se deben agregar los ingredientes en ciertas proporciones bien definidas para obtener una cantidad determinada de un producto especifico; por ejemplo, sería ilógico pensar que se pueden obtener el doble de galletas de lo que dice una receta sin duplicar la masa de todos los ingredientes. Así mismo ocurre en la química, todas las reacciones deben seguir ciertas proporciones másicas, que básicamente debe seguir cualquier combinación de materia.

Sabemos que debemos esperar siempre una proporción definida entre la masa de los reactivos y productos de una reacción. Fuente: pxhere.com, imagen CC0.
¿Qué son y cuáles son las leyes estequiométricas?
Sabemos que toda la materia existente es una combinación de los distintos elementos químicos que conforman nuestra tabla periódica, los cuales, combinados en diferentes proporciones dan origen a todos los compuestos químicos conocidos, bien sea de origen natural o sintético. Ahora bien, estas combinaciones no se producen de manera arbitraria, sino que siguen una proporción matemática constante de números enteros o múltiplos de los mismos, de modo que la materia involucrada en la reacción química ni se crea ni se destruye. A estas proporciones matemáticas que deben respetar las reacciones químicas se les conocen como “leyes estequiométricas”.
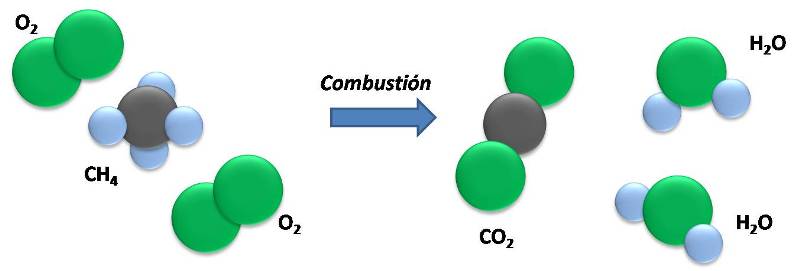
En la combustión del metano, antes y después de la reacción, el número de átomos es el mismo. Fuente: @emiliomoron.
Aunque estos son principios muy antiguos, siguen teniendo validez y son indispensables para el correcto balanceo y representación de una ecuación química, lo que es fundamental para poder realizar cualquier operación cuantitativa entre los reactivos y productos de la reacción. Son cuatro leyes muy bien conocidas hoy, y hasta podríamos decir que nos parecen evidentes, pero debemos considerar que cuando fueron enunciadas ni siquiera se conocían bien las masas atómicas de los elementos o a cuanto equivalía un mol de átomos, por lo que constituyeron todo un hito de la química que aun hoy sigue teniendo aplicación.
Estas cuatro leyes son
Ley de conservación de la masa
Esta es una de las leyes fundamentales de las ciencias naturales que expresa “En un sistema aislado, durante toda reacción química ordinaria, la masa total en el sistema permanece constante”[1].
Lo que básicamente quiere decir que en una reacción química, la masa total de los reactivos es igual a la masa total de los productos obtenidos, siempre que no haya un intercambio de masa y energía con los alrededores.
Esto viene a explicar que en una reacción química las sustancias no aparecen ni desaparecen como por arte de magia, de ahí la célebre frase “la materia ni se crea ni se destruye, solo se transforma”. Por ejemplo, un problema de la química del siglo XVIII era el desbalance de masa que se encontraba en ciertos metales que eran pesados antes y después de su oxidación.
Por ejemplo, esta ley explica porque el óxido de hierro pesa más que el hierro puro.
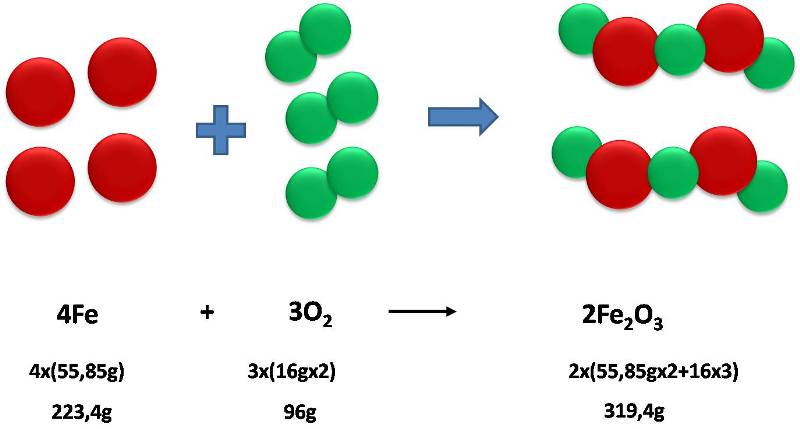
Antiguamente no tenían presente la masa del oxígeno en la reacción, por lo que percibían que el óxido de hierro era más pesado que el hierro puro. Fuente: @emiliomoron.
La oxidación del hierro no es más que su reacción con el oxígeno atmosférico, así que el producto de la reacción, el óxido, contiene tanto la masa inicial de hierro como la masa de oxígeno añadido durante el proceso. De modo que, la masa total de los átomos de reactivos es igual a la masa total de los productos.
Ley de las proporciones definidas
En una reacción química los elementos reaccionan siempre en cantidades fijas para producir un compuesto en especifico, podríamos decir por ejemplo que el agua, H2O, está compuesta por dos átomos de hidrógeno y uno de oxígeno sin importar cual sea su procedencia ni como se sintetiza.
Esta ley fue enunciada como “cuando se combinan dos o más elementos para dar un determinado compuesto, siempre lo hacen en una relación constante de masas”[2].
Considerando la siguiente reacción entre hidrógeno y oxígeno para obtener agua. En estado puro podemos decir que de forma invariable, para obtener agua se necesitaran combinar 1 mol de H2 con 2 moles de oxígeno. Podemos establecer la siguiente relación:
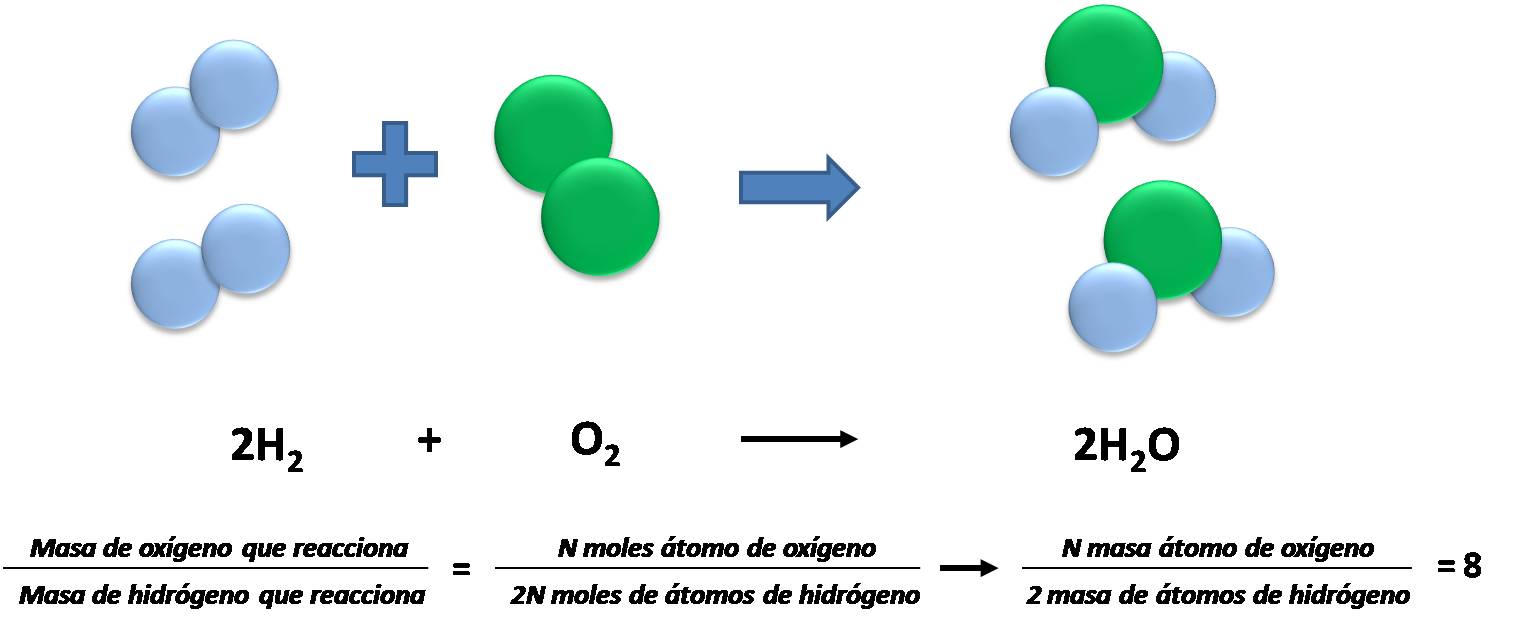
El cociente entre las masas de los reactivos y productos no cambia. Fuente: @emiliomoron.
Así se encuentra que el cociente entre las masas de los átomos que reaccionan es igual al cociente entre los moles de átomos multiplicados por una constante; y como la masas de los átomos no cambia, el cociente entre la masa de los productos tampoco.
Esta ley es aplicable para determinar la composición porcentual de los compuestos. Por ejemplo, usando el enunciado de esta ley podemos decir que el agua es un compuesto que siempre está formado por:
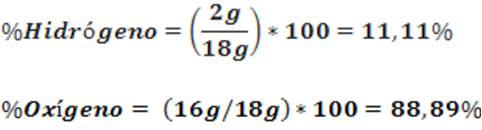
Ley de proporciones múltiples
Esta ley enuncia que “Cuando dos o más elementos se combinan para dar más de un compuesto, una masa variable de uno de ellos se une a una masa fija del otro, y la primera tiene como relación números canónicos e indistintos”[3].
Quizás este enunciado es el más complejo, pero no es difícil de entender con el ejemplo adecuado. Retomemos como ejemplo el agua, está formada por los átomos de hidrógeno y oxígeno, pero estos dos elementos pueden formar otros compuestos, como por ejemplo el peróxido de hidrogeno H2O2.
Veamos cómo se cumple esta ley con estos dos compuestos, asumiendo un mol de compuestos:
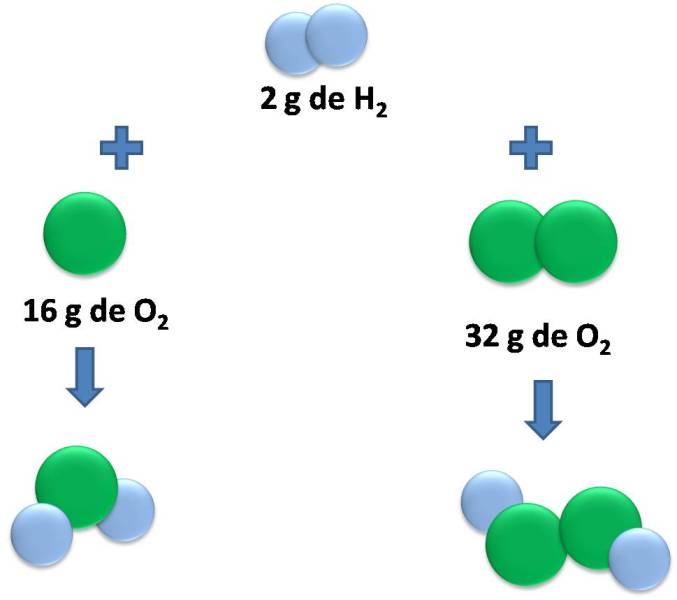
Este ejemplo explica como funciona la ley de las proporciones múltiples. Fuente: @emiliomoron.
En un mol de agua, 2 g de hidrógeno se combinan por cada 16 g de oxígeno, mientras que en el peróxido de hidrogeno, hay 2 g de hidrógeno por cada 32 g de oxígeno. Por tanto, la proporción de oxígeno en ambos compuestos es 1:2, un numero entero en relación sencilla.
Esta ley tiene algunas limitaciones, ya que las masas atómicas de los elementos no son números enteros sino que contienen decimales, lo que nos deja relaciones más complejas, y entre algunos compuestos muy pesados como los hidrocarburos, las relaciones dejan de ser pequeñas como 1:2 sino más bien 121:120 como entre el C10H22 y el C11H24. Sin embargo es muy útil e importante para establecer la relación entre las formulas moleculares de compuestos que tienen los mismos elementos.
Ley de las proporciones reciprocas
Esta ley fue de gran importancia para la química ya que contribuyó para construir la definición de mol y peso equivalente, y expresa que “Las masas de dos elementos diferentes que se combinan con una misma cantidad de un tercer elemento, guardan la misma relación que las masas de aquellos elementos cuando se combinan entre sí”[4].
Dicho de una forma más sencilla, si tenemos dos compuestos, digamos AB y CB, podremos notar que hay un elemento común entre ellos, B; y si conocemos la masa de A que reacciona con B para producir AB y se conoce la masa de C que reacciona con B para dar CB, entonces, se podría calcular la masa de A que se necesitaría para reaccionar con C y producir AC.
Aunque quizás esta ley nos parezca la más abstracta de todas, podríamos considerarla desde un punto de vista matemático para darnos cuenta que solo se trata de construir factores de equivalencia.
Por ejemplo, si tenemos que 63,5 g de cobre reaccionan con 16 g de oxígeno para formar óxido de cobre, CuO, y que en el sulfuro de cobre, CuS, reaccionan 63,5 g de cobre con 32 g de azufre, dividiendo las dos proporciones podemos obtener la relación en la que reaccionaria el azufre con el oxígeno.
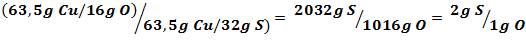
Como vemos en el ejemplo, se simplifica la relación con el Cu, el elemento común entre los dos compuestos, y obtenemos la relación S/O.
En ocasiones esta ley tambalea cuando no se ajustan bien los decimales de las masas de los elementos, y aunque en la química moderna se utiliza más el concepto de peso equivalente, que es la cantidad de un elemento o compuesto que reacciona con una cantidad fija de una sustancia de referencia, sin duda esta ley fue útil para llegar a esa definición.
Bueno amigos, aunque en la actualidad utilizamos conceptos más ajustados a la química moderna, estas leyes fueron una gran contribución para la compresión de la forma en que reaccionan los compuestos y establecer sus distintas formulas químicas.
Muchas gracias por la lectura amigos, espero que les haya gustado la información, hasta la próxima!
Referencias
- Wikipedia.com. Ley de conservación de la masa
- Wikipedia.com. Ley de proporciones definidas
- Wikipedia.com. Ley de proporciones multiples
- Wikipedia.com. Ley de las proporciones reciprocas.
Las fórmulas y estructuras químicas fueron elaboradas en power point.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Hola @emiliomoron, Tu publicación ha sido votada por parte de Edu-venezuela. Su publicación se transferirá a otros proyectos de curación para obtener más apoyo de voto. ¡Sigan con el buen trabajo!
Muchas gracias por el apoyo @edu-venezuela!
muy bueno el articulo
Muchas gracias amigo.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Gracias por el apoyo amigos!
https://twitter.com/EspanolStem/status/1377606477754556418