CONCEPTOS FUNDAMENTALES DE LA TERMODINAMICA - PARTE 3
Para toda la comunidad de Hive, mis cordiales saludos. Particulares saludos para todos mis Hive-Lectores y Hive-Seguidores. En esta oportunidad les comparto la tercera y última parte de mi serie de posts titulados CONCEPTOS FUNDAMENTALES DE LA TERMODINAMICA. Como lo expresé en las anteriores partes, considero que conociendo este material es posible abordar posteriormente, con mucha mayor facilidad y claridad, contenidos específicos de Termodinámica. Además, creo que representa un material muy útil para los estudiantes que, por el COVID-19, deben seguir sus estudios en casa.
Al hacer click en los siguiente enlaces, serás dirigido al contenido de de las partes 1 y 2 del presente post:

Hive-Lectores, procedo ahora a continuar con el contenido.
10 - ECUACION DE ESTADO:
Una Ecuación de Estado es una ecuación que relaciona, para un sistema en equilibrio termodinámico, las variables termodinámicas que lo describen, permitiendo determinar las desconocidas (dependientes) a partir de valores conocidos de otras variables (independientes). Vean la figura 1. |
|---|
Tiene la forma general,
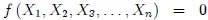
donde  son las variables termodinámicas del sistema objeto de estudio.
son las variables termodinámicas del sistema objeto de estudio.

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
No existe una única ecuación de estado que describa el comportamiento de todas las sustancias para todas las condiciones de presión y temperatura.
La ecuación de estado más sencilla es aquella que describe el comportamiento de un gas a baja densidad, por lo que pueden hacerse las siguientes aproximaciones:
- No hay interacciones entre las moléculas del gas.
- El volumen de las moléculas es nulo.
La ecuación de estado que describe un gas en estas condiciones se llama Ecuación de Estado de un gas ideal (un gas idealizado, no existe en realidad), que relaciona las variables: presión, volumen, temperatura y número de moles del gas:
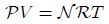
donde, como ya les había indicado en mis posts anteriores, 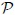 es la presión,
es la presión, 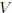 el volumen,
el volumen, 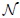 el número de moles de gas,
el número de moles de gas, 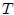 es la temperatura en la escala Kelvin (
es la temperatura en la escala Kelvin (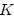 ). La cantidad
). La cantidad 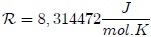 es la Constante Universal de los Gases, encontrada experimentalmente igual para todos los gases.
es la Constante Universal de los Gases, encontrada experimentalmente igual para todos los gases.

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint, Word y PhotoScape
De la ecuación de estado (12)se pueden escribir las ecuaciones que les muestro en la figura 2, que son leyes particulares válidas para los gases ideales.
La ecuación de estado se puede o no expresar mediante una ecuación analítica y proviene siempre de los experimentos o de una teoría de la materia. De ningún modo se puede considerar que surge de la Termodinámica.
10 - TRANSFORMACION TERMODINAMICA:
Una Transformación Termodinámica o Proceso Termodinámico es cualquier cambio experimentado por un sistema, por algún método de operación, de un estado de equilibrio termodinámico a otro, es decir, se verifica un cambio de estado. Durante una transformación termodinámica, al menos, cambia de valor una variable termodinámica del sistema a lo largo del tiempo. Vean la figura 3 |
|---|

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Cualquier transformación puede realizarse por muy diversas maneras. El interés de la termodinámica se centra en los estados inicial y final de las transformaciones, independientemente del camino seguido. Eso es posible gracias a las variables termodinámicas.
La Trayectoria de la Transformación Termodinámica es la serie o sucesión de estados de equilibrio por los que pasa un sistema durante una determinada transformación termodinámica. Indica la evolución del sistema. Vean la figura 4 |
|---|
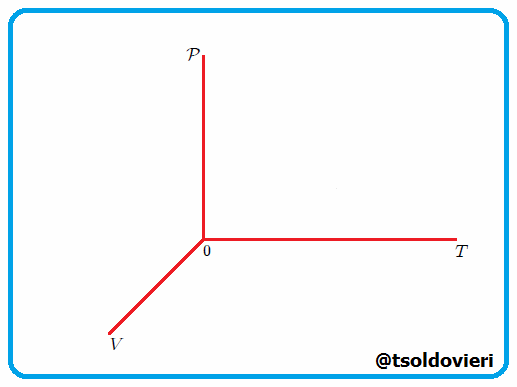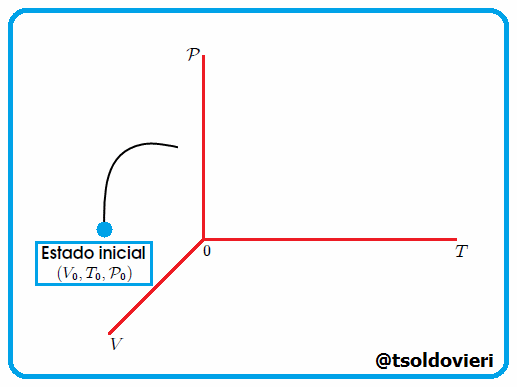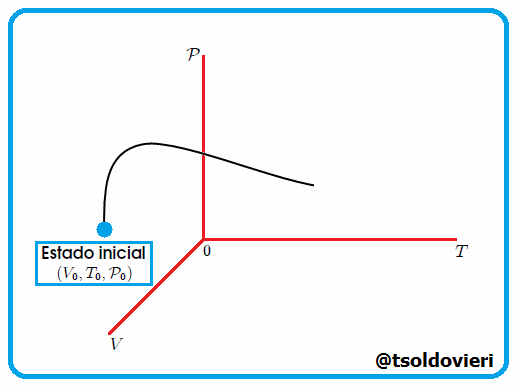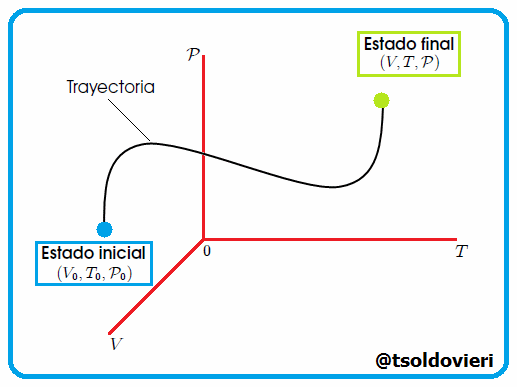
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Mientras tiene lugar una transformación termodinámica no hay equilibrio y no se puede aplicar ninguna ecuación de estado.
El cambio sufrido por el sistema debido a una transformación termodinámica queda definido sólo cuando se indica: el estado inicial del sistema, el estado final del sistema y la trayectoria o camino seguido en la transformación, como les muestro en la figura 1. |
|---|
11 - TIPOS DE TRANSFORMACIONES TERMODINAMICAS:
El cambio de estado puede conseguirse por distintas transformaciones:
11.1 - TRANSFORMACION ADIABATICA:
Es una transformación termodinámica en la cual la frontera del sistema no permite el intercambio de calor con su entorno, es decir, la frontera involucrada es adiabática. Esta situación se tendría cuando hubiese un aislamiento térmico perfecto del sistema o cuando la transformación ocurriera tan rápido que no hubiese prácticamente transferencia de calor. En la figura 5 les muestro una transformación de este tipo.
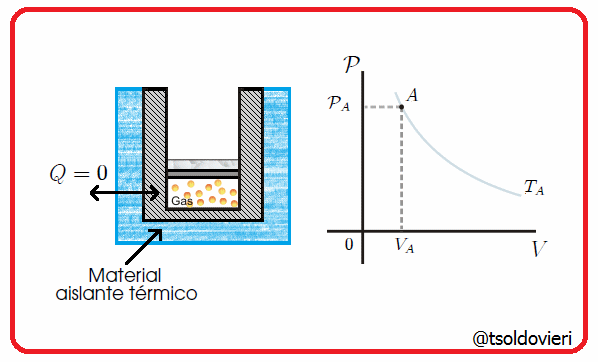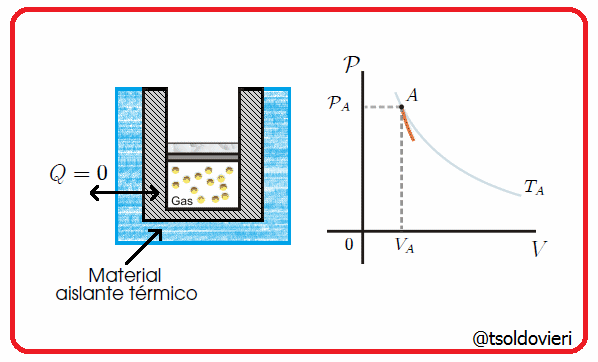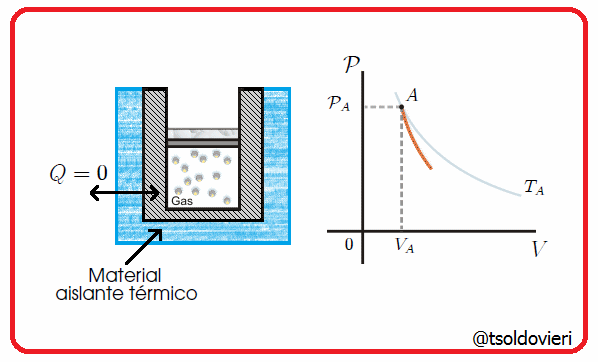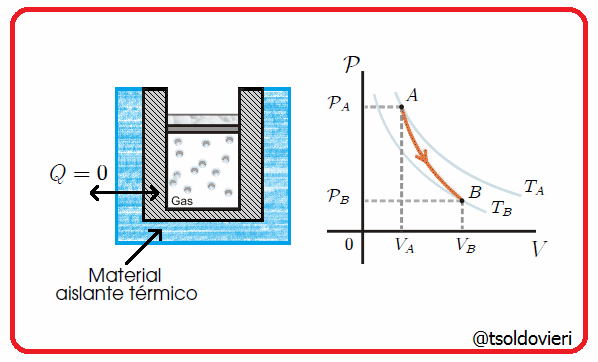
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Por ejemplo, la compresión del pistón en una bomba de inflado de ruedas de bicicleta, o la descompresión rápida del émbolo de una jeringa (previamente comprimido con el agujero de salida taponado). También son ejemplos las transformaciones que pueden realizarse dentro de un termo para bebidas.
11.2 - TRANSFORMACION DIATERMICA:
Es una transformación termodinámica en la cual la frontera del sistema permite el intercambio de calor con su entorno, es decir, la frontera involucrada es diatérmica.
11.3 - TRANSFORMACION ISOTERMICA:
Es una transformación termodinámica donde la temperatura permanece constante. En la figura 6 les muestro una transformación de este tipo.
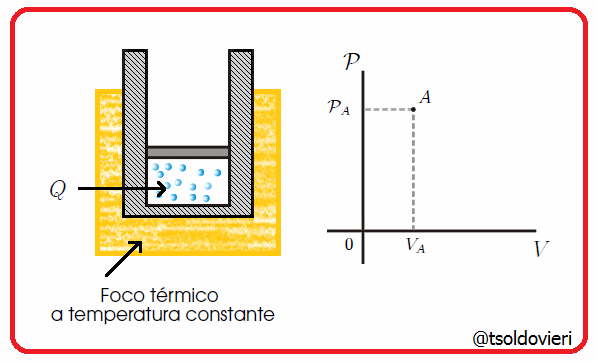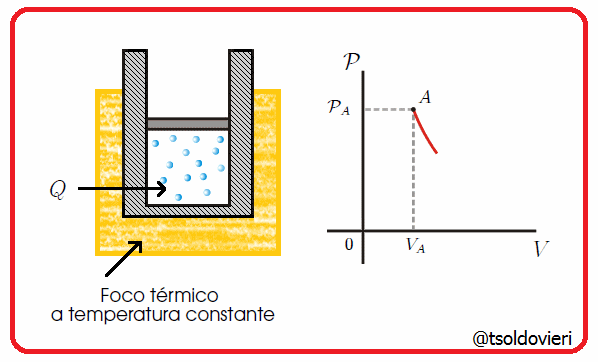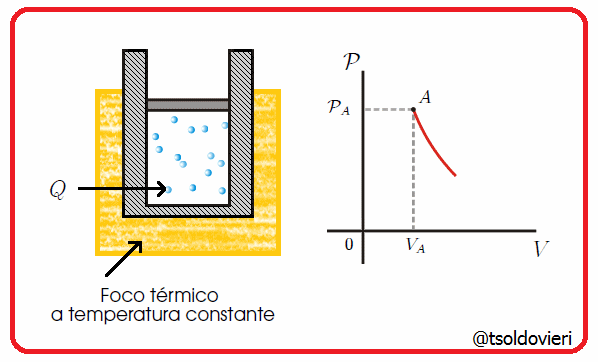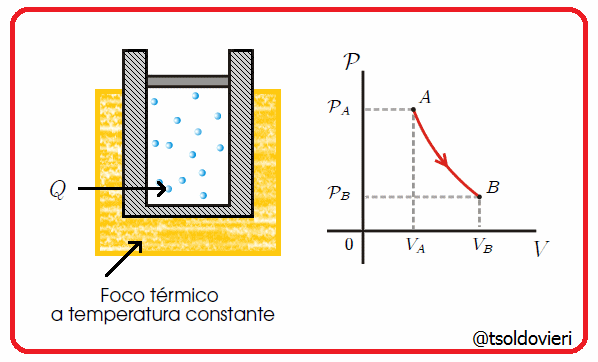
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Por ejemplo, un globo en una maquina de hacer vacío que aumenta su volumen a medida que se va haciendo el vacío.
11.4 - TRANSFORMACION ISOBARICA:
Es una transformación termodinámica donde se mantiene constante la presión. En la figura 7 les muestro una transformación de este tipo.
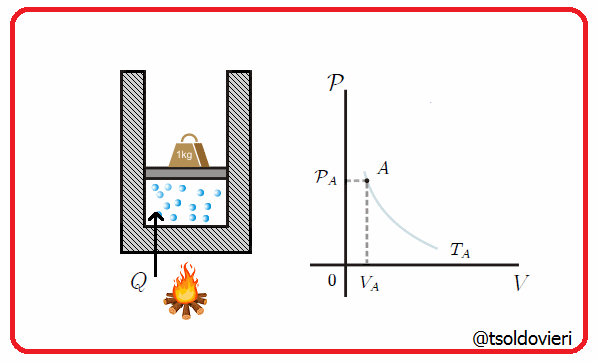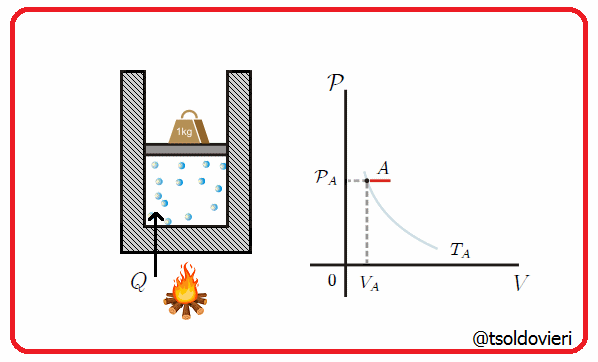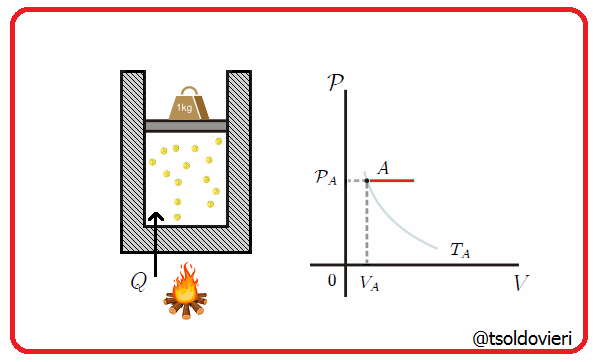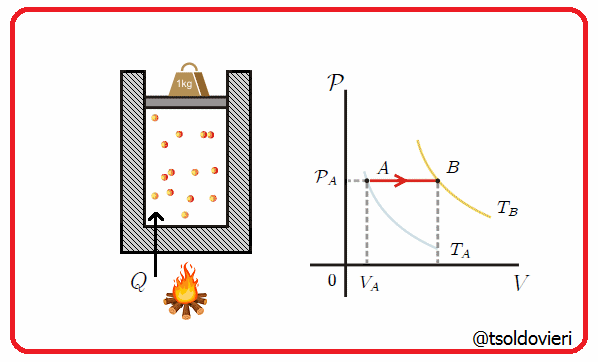
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Un ejemplo lo tenemos cuando se mete un globo en una nevera y observamos que se encoge. A medida que cambia la temperatura, el volumen cambiaa de forma que pueda mantenerse la presión.
11.5 - TRANSFORMACION ISOCORICA O ISOMETRICA:
Es una transformación termodinámica donde se mantiene constante el volumen, es decir, la frontera involucrada es rígida. En la figura 8 les muestro una transformación de este tipo.
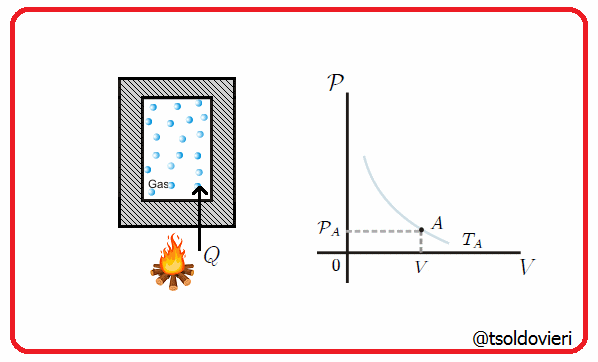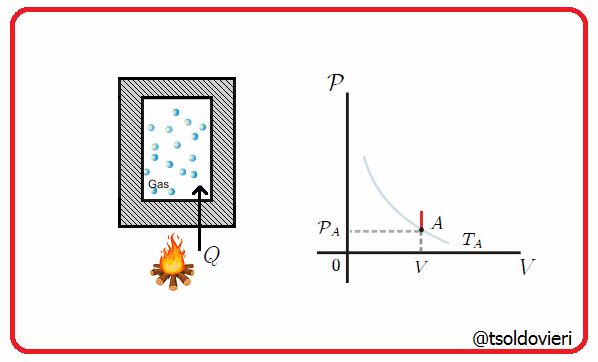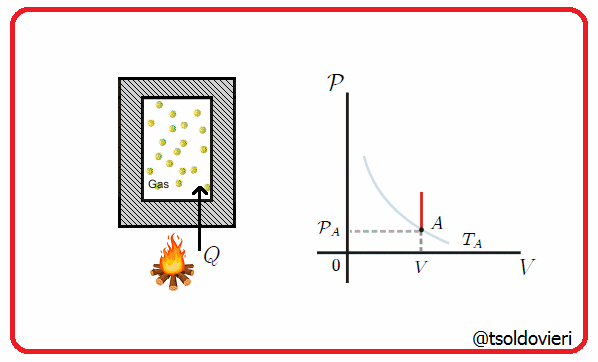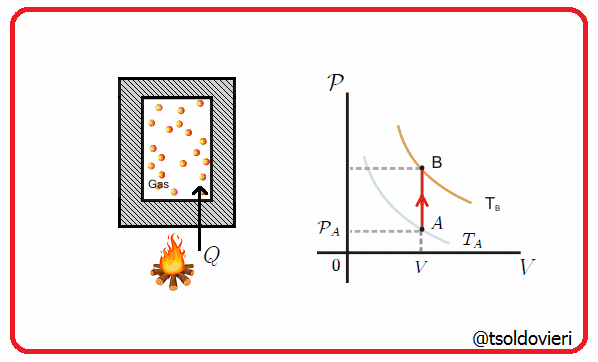
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Por ejemplo, el vapor en una olla a presión va aumentando su presión a medida que se calienta, pero el volumen se mantiene.
11.6 - TRANSFORMACION CICLICA O CERRADA:
Es una transformación donde el sistema, a través de una serie de transformaciones termodinámicas, finalmente vuelve a su estado inicial. El estado inicial es igual al estado final.
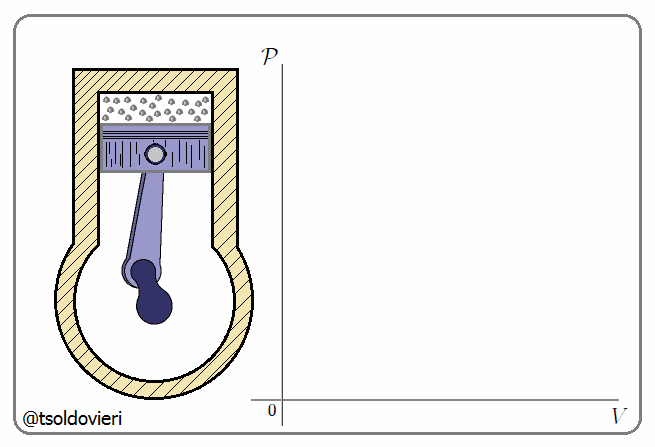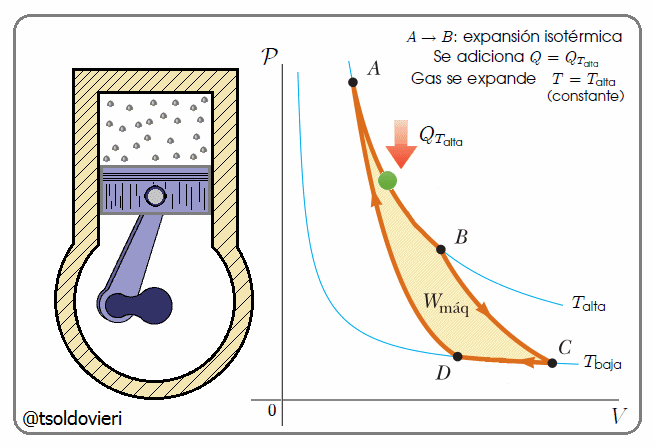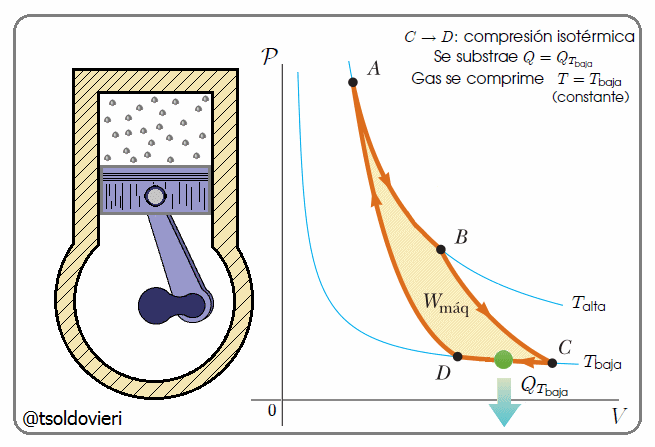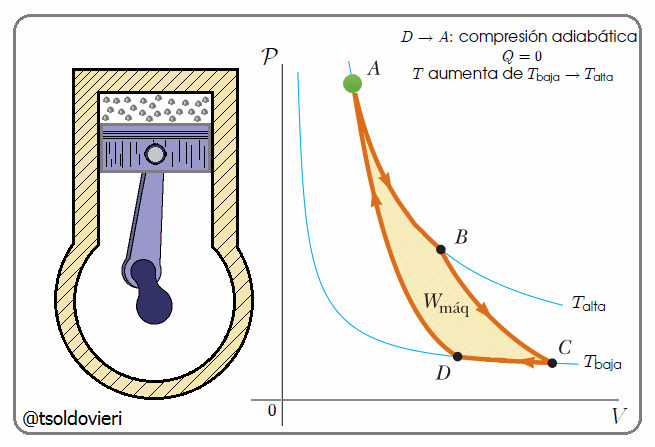
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
En la figura 9, mis estimados amigos lectores, les presento el Ciclo de Carnot ideado por el científico francés Sadi Carnot 1796-1832 (ver inicio de la PARTE 1 del presente post), que es una transformación cíclica idealizada, pues no hay pérdida de energía.
El ciclo idealizado de Carnot (Máquina de Carnot) consta de cuatro procesos realizados en un ciclo, dos de los cuales son adiabáticos (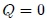 ) y los otros dos son isotérmicos (
) y los otros dos son isotérmicos (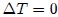 ). Se consideró que cada uno de los procesos se realizaba de manera reversible. Es decir, cada uno de los procesos (por ejemplo, durante la expansión de los gases contra un pistón) se hizo tan lentamente que el proceso podría considerarse una serie de estados de equilibrio, y todo el proceso se podría realizar a la inversa sin cambio en la magnitud del trabajo efectuado o del calor intercambiado (Transformación Reversible). Por otra parte, un proceso real ocurriría más rápidamente; habría turbulencia en el gas, la fricción estaría presente, etcétera. Por todos estos factores, no es posible efectuar un proceso real exactamente a la inversa: la turbulencia sería diferente y la pérdida de calor por fricción no se invertiría por sí misma. Por ende, los procesos reales son irreversibles (Transformación Irreversible).
). Se consideró que cada uno de los procesos se realizaba de manera reversible. Es decir, cada uno de los procesos (por ejemplo, durante la expansión de los gases contra un pistón) se hizo tan lentamente que el proceso podría considerarse una serie de estados de equilibrio, y todo el proceso se podría realizar a la inversa sin cambio en la magnitud del trabajo efectuado o del calor intercambiado (Transformación Reversible). Por otra parte, un proceso real ocurriría más rápidamente; habría turbulencia en el gas, la fricción estaría presente, etcétera. Por todos estos factores, no es posible efectuar un proceso real exactamente a la inversa: la turbulencia sería diferente y la pérdida de calor por fricción no se invertiría por sí misma. Por ende, los procesos reales son irreversibles (Transformación Irreversible).
Observen nuevamente la figura 9 mis atentos lectores. El ciclo para la Máquina de Carnot comienza en el punto 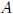 del diagrama
del diagrama 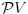 . (1) Primero se expande el gas isotérmicamente, con la adición de calor
. (1) Primero se expande el gas isotérmicamente, con la adición de calor 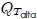 , a lo largo de la trayectoria
, a lo largo de la trayectoria 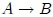 a temperatura
a temperatura 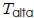 . (2) A continuación, el gas se expande adiabáticamente en la trayectoria
. (2) A continuación, el gas se expande adiabáticamente en la trayectoria 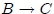 ; no se intercambia calor, pero la temperatura desciende a
; no se intercambia calor, pero la temperatura desciende a 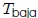 . (3) Entonces el gas se comprime a temperatura constante
. (3) Entonces el gas se comprime a temperatura constante 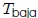 , en la trayectoria
, en la trayectoria 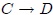 , y el calor
, y el calor 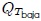 fluye hacia fuera. (4) Finalmente, el gas se comprime adiabáticamente, en la trayectoria
fluye hacia fuera. (4) Finalmente, el gas se comprime adiabáticamente, en la trayectoria 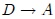 , de vuelta a su estado original.
, de vuelta a su estado original.
Ejemplos de sistemas donde se llevan a cabo transformaciones cíclicas lo constituyen los motores de combustión, los motores de vapor, turbinas, etc.
11.8 - TRANSFORMACION CUASIESTATICA O DE CUASIEQUILIBRIO:
Es una transformación que tiene lugar de forma infinitamente lenta o con un número muy grande de pasos. |
|---|
Generalmente, el anterior hecho implica que el sistema pasa por sucesivos estados de equilibrio infinitesimalmente cercanos, es decir, el sistema está en todo momento muy cerca del estado de equilibrio.
Una transformación de este tipo puede considerarse lo suficientemente lenta como para permitirle al sistema ajustarse internamente, de modo que las variables termodinámicas de una de sus partes no cambien más rápido que las de otras.
Se debe destacar que,
En este tipo de transformaciones se tienen bien definidas las variables termodinámicas. Las modificaciones ejercidas sobre el sistema por fuerzas externas, se idealizan como fuerzas que sólo varían infinitesimalmente a lo largo de toda la transformación termodinámica, por lo que esta descripción idealizada permite definir una ecuación de estado para el sistema a lo largo de toda la transformación. |
|---|
La razón para que la variación de las fuerzas externa sea infinitesimal, obedece al hecho de que una fuerza finita provoca siempre estados en desequilibrio (turbulencia en un gas, ondas, distribución no uniforme de temperaturas, etc.) que impiden que el sistema pueda describirse en esos estados mediante variables termodinámicas.
Una transformación cuasiestática no existe en la naturaleza, es una idealización. |
|---|
11.9 - TRANSFORMACION REVERSIBLE:
Es una transformación cuasiestática que puede ser llevada de nuevo al estado inicial pasando por los mismos estados intermedios que la transformación directa, es decir, por la misma trayectoria; sin que al final, ni en el sistema ni en el entorno, quede ningún efecto residual que pueda revelar que se ha verificado la transformación. |
|---|
Para que lo anterior suceda, no debe haber rozamientos ni deformaciones, es decir, efectos disipativos. No habrá degradación de la energía y por ello ninguna generación o producción de entropía.
Como ejemplo, considérese una banda elástica colocada en forma vertical al ser fijada en uno de sus extremos a un soporte fijo y a la cual se le coloca un recipiente en el otro extremo. Se hace estirar la banda al agregar cantidades infinitesimales de arena en el recipiente. El estiramiento es una sucesión de transformaciones infinitesimales que pueden invertirse en cualquier momento al retirar cantidades infinitesimales de arena. La misma acción invertida, invierte a su vez el sentido del estiramiento de la banda. La anterior transformación es:
- Cuasiestática: porque los estados intermedios son de equilibrio, puesto que el sistema tiene tiempo de ajustarse a cada nueva tensión.
- Reversible: porque la contracción es realizable en cualquier momento llevando a cabo la misma clase de manipulaciones.
Una transformación reversible es, necesariamente, cuasiestática. Reversibilidad y equilibrio son equivalentes. Este tipo de transformaciones son una idealización por ser cuasiestáticas, por lo tanto, no existen en la naturaleza. |
|---|
11.10 - TRANSFORMACION IRREVERSIBLE:
Es una transformación que no es reversible ya que los estados intermedios de la misma no son de equilibrio. |
|---|
Todas las transformaciones que ocurren en la naturaleza son irreversibles. En ellas siempre habrá degradación de energía y generación de entropía. Pueden ser de dos tipos:
11.10.1 - TRANSFORMACION IRREVERSIBLE CUASIESTATICA:
Es una transformación cuasiestática en la que se presentan efectos disipativos. |
|---|
Como ejemplo, considérese un gas contenido en un cilindro vertical provisto de un pistón o émbolo sobre el cual se coloca una determinada masa de arena. El gas se calienta lentamente utilizando una pequeña resistencia eléctrica y como consecuencia, el gas se va expandiendo lentamente, es decir, cuasiestáticamente. La anterior transformación es:
- Cuasiestática: ya que el gas se va expandiendo lentamente pasando por estados intermedios de equilibrio, puesto que el sistema tiene tiempo de ajustarse a cada nueva temperatura.
- Irreversible: ya que no es posible lograr que el gas se enfríe con la misma clase de manipulación, es decir, únicamente en contacto con la resistencia eléctrica.
11.10.2 - TRANSFORMACION IRREVERSIBLE NO-CUASIESTATICA:
Es una transformación tal que entre el estado inicial y el estado final no ocurren estados de equilibrio intermedios, no cumpliéndose las condiciones descritas en la sección anterior. |
|---|
Como ejemplo, considérese un sistema complejo que consta de dos subsistemas a temperaturas diferentes que están aislados mediante una frontera adiabática. Al poner en contacto térmico directo los dos subsistemas, eliminando la frontera adiabática, se acaba por alcanzar un estado de equilibrio caracterizado por una temperatura uniforme. Ni el sistema ni los subsistemas pasan por estados de equilibrio intermedios, por lo que la transformación es no-cuasiestática.
En la naturaleza toda transformación es irreversible, sin embargo, algunas se pueden idealizar para acercarse a la reversibilidad. Es de hacer notar que las transformaciones irreversibles introducen una serie de efectos, pero siempre en el mismo sentido. Así, en una expansión adiabática (no hay intercambio de calor) reversible y en una irreversible, con el mismo volumen final, la temperatura final es mayor siempre en la transformación irreversible. En una compresión adiabática, también sucede lo mismo.
(A) En la transformación irreversible, la temperatura final es mayor que en la transformación reversible. (B) Una transformación reversible es necesariamente cuasiestática, sin embargo, una transformación cuasiestática puede no ser reversible. |
|---|
MIS ATENTOS LECTORES, CON ESTE POST HE FINALIZADO CON MI SERIE DE 3 POSTS ACERCA DEL PRESENTE TEMA

BIBLIOGRAFIA RECOMENDADA
Aquí les presento 7 textos que recomiendo si desean ahondar en el tema:
Soldovieri C., T. FISICA GENERAL - UNA INTRODUCCION A LOS FLUIDOS, VIBRACIONES Y TERMODINAMICA. Preprint, 2020. El borrador se puede descargar desde mi web www.tsoldovieritsweb.ihostfull.com
Bauer, W. & Westfall, G. D. FISICA PARA INGENIERIA Y CIENCIAS, volume 1. McGraw-Hill/Interamericana de México, S. A. de C. V., 2011.
Bueche, F. J. & Hecht, E. FISICA GENERAL. Schaum. McGraW-Hill / Interamericana Editores, S.A. de C.V., México, 10ma edition, 2007.
Fishbane, P. M.; Gasiorowicz, S. G. & Thornton, S. T. PHYSICS FOR SCIENTISTS AND ENGINEERS WITH MODERN PHYSICS. Pearson Education Inc., 3th edition, 2005.
Burbano de E., S.; Burbano G., E. & Gracia M., C. FISICA GENERAL. Editorial Tébar, S.L., 2003.
Halliday, D.; Resnick, R. & Krane, K. S. FISICA, volume 2. Compañía Editorial Continental, S.A. de C.V., México, 4ta edition, 1994.
Hewitt, P. G. CONCEPTOS DE FISICA. Editorial Limusa, México, 1era edition, 1992.
WEB: https://www.ejemplos.co/30-ejemplos-de-sistema-abierto-cerrado-y-aislado/


Estimados amigos Lectores. Espero que la anterior información les sea de mucha utilidad. Si tienen preguntas, no duden en hacérmelas llegar pues, con mucho gusto, les atenderé. Igualmente, si tienen detalles que puedan nutrir o mejorar la anterior información, por favor, háganmelas saber. Hasta la siguiente parte del presente post ¡Saludos a todos! 😁.
LES INVITO VISITAR MI WEB PERSONAL www.tsoldovieritsweb.ihostfull.com
En esta página web podrás conseguir los borradores de los libros de texto que estoy escribiendo y varias listas de problemas con respuestas de: Optica, Mecánica Clásica, Mecánica Cuántica, Física General 1, Física General 2 y Física General 3. También encontrarás enlaces a otras páginas web de interés.
Deja tus comentarios en el libro de visitas! 😁

Excelente trabajo amigo, como siempre ! Seguimos en comunicación !
Gracias amigo @amectyj ¡Saludos!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Thanks for the support @steemstem @stemsocial
Excelente el abordaje completo que ha hecho en estos 3 post de la serie temática Conceptos fundamentales de la termodinámica, sin lugar a dudas cuando me asignen la unidad curricular de termodinámica, que comúnmente en la universidad me la asignan en los intensivos considerare estos post como parte complementaria de mis clases. Saludos colega y bendiciones para usted.
Gracias amigo @carlos84 por la muy buena referencia que haces de mis posts. Muy gratificante para mi persona es el que consideres usarlos para tus clases. Te invito a pasar por mi web http://www.tsoldovieritsweb.ihostfull.com , donde podrás encontrar los borradores de los textos que estoy escribiendo. En particular, está uno de Física General que contiene una parte dedicada a la Termodinámica. Te invito a que lo descargues y me des tu opinión y sugerencias. Te invito también a dejar tus comentarios el el libro de visitas de la página. Saludos cordiales colega.
Felicidades por este artículo tan completo donde explicas los procesos termodinámicos de forma muy didáctica, soy Ing. Civil y mi fuerte no es esta área, pero no se me hizo complicado entender los conceptos involucrados. Felicidades por las ilustraciones, los gifs son de calidad. Saludos!
Me alegra y satisface mucho que mis posts te parezcan de utilidad y que consideres que sean buenos para transmitir el conocimiento que abordan. Gracias por la referencia a mis gifs. Los gifs animados involucran un trabajo laborioso, pero la recompensa en cuanto a su poder explicativo lo supera por mucho. Gracias por tu grato comentario. Un cordial saludo.
Estuve revisando tu publicación a través de hiveblocks para ver el código detrás ya que me llamó mucho la atención el fondo gris detrás de las letras en negrita. No me imaginé que se podía usar el código de tablas para hacer eso:
-Sin código de tabla-
También vi que usted coloca frecuentemente el código
<div class="text-justify"> </div>para justificar párrafos.Puede simplificar colocando solo
<div class="text-justify">al principio del post y</div>al final. De esta manera aligera un poco la visualización de palabras cuando cree y edite sus posts.Saludos.
Amigo @acont. Mil gracias por tu sugerencia. Obviamente, la pondré en práctica en el programa editor Markdown que uso para escribir mis posts (en general no uso el editor de Hive para no estar siempre en línea, pues mi internet es limitada). Me acostumbré a usar ese código de esa forma desde cuando era novato y, como copio y pego la estructura de viejos posts para escribir los nuevos, entonces he mantenido los códigos así. Gracias por tu comentario. Saludos.
Congratulations @tsoldovieri! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board And compare to others on the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPSupport the HiveBuzz project. Vote for our proposal!
thanks!
You're welcome @tsoldovieri 👍❤️
cheers, liz