Medición de calor. Calorimetría
¡Hola estimados amigos!
Ahora bien, esa cantidad de calor que se produce o absorbe, resulta importante medirlo en muchos casos, ya que permite obtener información necesaria para calcular valores de entalpía como por ejemplo los valores estándar de formación.
Esta medición básicamente se basa en la medición del flujo de calor que se produce de un objeto a otro y la medición experimental se conoce como calorimetría. A continuación se detallará como se puede realizar la medción del calor.

Fuente: Imagen realizada en power point con imagen tomada de wikimedia.org
Hay que comenzar tomando en cuenta que cuando un cuerpo experimenta cambios de temperatura, la cantidad de calor absorbida viene determinada por su capacidad calorífica. Esta se define como la cantidad de calor necesario para cambiar la temperatura en 1°C.
La capacidad calorífica puede expresarse por medio de la siguiente relación
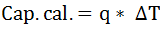
En esta expresión, q corresponde al flujo total de calor desde o hacia el objeto y ∆T es el cambo que se produce en la temperatura por el flujo de calor.
Para la medición del cambio de temperatura se emplea un dispositivo conocido como calorímetro, dependiendo de los procesos bajo estudio dependerá el tipo de calorímetro empleado.
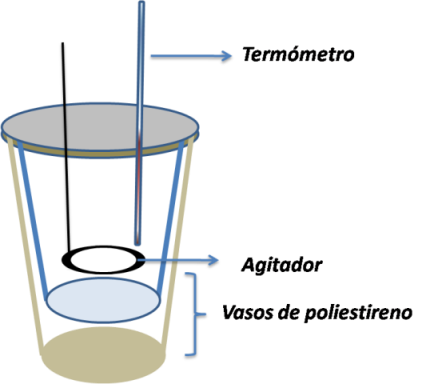
A nivel de laboratorio por ejemplo, generalmente se trabaja con un calorímetro simple muy comúnmente conocido como “vaso de café´” y presenta la siguiente estructura.
Fuente: @yusvelasquez
Como se puede observar su estructura es sencilla y se compone de dos recipientes, un recipiente con propiedades aislantes y en donde se inserta un recipiente que contiene la disolución acuosa con la que se trabajará. Se trabajan con reacciones en donde no participan reactivos ni productos gaseosos, la presión y el volumen permanecen constantes durante la medición.
En su parte superior se coloca una tapa aislante que posee dos orificios que permite que la cantidad de calor perdido sea insignificante. En un orificio se coloca un termómetro que permita medir los cambios de temperatura, y en el otro un agitador con la finalidad de mover el contenido del recipiente.
Aplicación cuantitativa
Con los datos obtenidos en la medición de temperatura es posible calcular el calor de la reacción. Supóngase que se tienen los siguientes datos empleando un calorímetro de vaso de café. Se mezclan 25g de HCl a 1M y 25g de NaOH en un calorímetro de taza de café. La temperatura de la disolución resultante aumenta de 21°C a 27.5°C. Supóngase que se necesitan 2.14J para aumentar la temperatura de 1g de disolución a 1°C . ¿Cuál es el calor de la reacción?
Comencemos por escribir la reacción
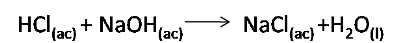
En este caso se puede calcular la capacidad calorífica del líquido ignorando la capacidad calorífica del vaso y la variación de temperatura de la siguiente forma:
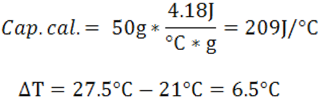
Una vez calculada la capacidad calorífica se calcula el calor de la reacción
q= Cap. Cal. * ∆T
q=209 J/ °C * 6.5°C =1.88 kJ
Este tipo de calorímetro es muy empleado en laboratorios, por ejemplo en la elaboración de proyectos de estudiantes de secundaria ya que se puede construir con materiales reciclados o fáciles de encontrar y se conocen como calorímetros caseros.
Calorímetro casero
Para su construcción se pueden emplear materiales como vaso térmico para la parte exterior, una lata de aluminio para la parte interior, algodón, papel de aluminio, termómetro y agitador.
La construcción consiste en colocar papel alumnio por toda la parte externa del vaso térmico, colocar la lata de alumnio en la parte interna del recipiente térmico rodeado de un aislante como algodon, previamente determinado su peso en una balanza. Construir una tapa con la que se garantice quede bien cerrado el recipiente y envolverla con papel aluminio.

Fuente: @yusvelasquez
Uno de los fines prácticos de este calorímetro casero es la medición de la tranferencia de calor del agua. Para lo cual se emplea una balanza y se comienza por pesar una cantidad de agua fría, la que posteriormente se coloca en la parte interna del calorímetro y se mide su temperatura. Luego se calienta una cantidad de agua, se determina su peso y su temperatura inicial y se coloca seguidamente en el calorímetro. Este finalmente se tapa muy bien, se agita, y se mide la temperatura de equilibrio pasado unos minutos cuando se estabilice.

Fuente:@yusvelasquez
Otra de las reacciones más importantes estudiadas en base a la calorimetría es la reacción de combustión, en donde se emplea la bomba calorimétrica y que se muestra a continuación.
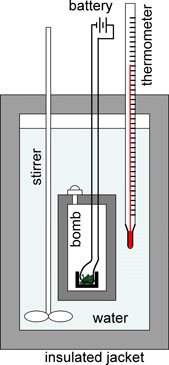
Fuente: wikimedia.org
En este caso, se coloca la muestra en un vaso pequeño dentro de un dispositivo llamado bomba que está sellada, contiene una válvula de entrada para introducir oxígeno y un contacto eléctrico que permite iniciar la reacción de combustión. Al colocar la muestra en la bomba, se sella y se somete a presión con el oxígeno. Seguidamente se coloca en el calorímetro que consta de un recipiente aislado y cubierto con agua la cual se mide previamente con exactitud.
Al colocar todos los componentes en el equipo, todos poseen la misma temperatura, y se comienza con la reacción de combustión haciendo pasar corriente eléctrica a través de unos alambres finos que están en contacto con la muestra, es así como la muestra se quema al entrar en contacto con el alambre caliente.
Como esta reacción es exotérmica, se libera calor el cual es absorbido por lo que está contenido en el calorímetro y se eleva la temperatura del agua, por lo que se mide la temperatura antes de la reacción y después que se efectúa. Es así como para calcular el calor de la reacción, es necesario conocer la capacidad calorífica del calorímetro.
Aplicación cuantitativa
En este caso, con los datos obtenidos de igual forma es posible calcular el calor de una reacción. Supongamos que en una bomba calorimétrica se eleva la temperatura 1.17°C cuando 0.5g de N2H4 se quema. La capacidad calorífica del calorímetro es de 16.53Kj/°C. ¿Qué cantidad de calor se libera en la reacción?
La cantidad de calor liberado viene dado por la ecuación
q= 16.53kJ/°C * 1.17°C
q= 19.3kJ
Como vemos la calorimetría resulta muy interesante y fácil de aplicar, por lo que se deben conocer los tipos de calorímetros y de esta forma poder seleccionar en función al tipo de reacción en estudio. Básicamente su función es la de aislar el sistema teniendo una porción fija en los alrededores para que los cambios de temperaturas se puedan medir con mayor exactitud y de esta manera realizar los cálculos necesarios.
Referencias
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
- Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México.
- Francisco Salazar. Calorimetría
- Lifeder.com. Calorimetría: que estudia y sus aplicaciones
Congratulations @yusvelasquez! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s):
Your next target is to reach 60000 upvotes.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPCheck out the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.