Estudio del porcentaje de disociación de ácidos y bases débiles
Hola amigos
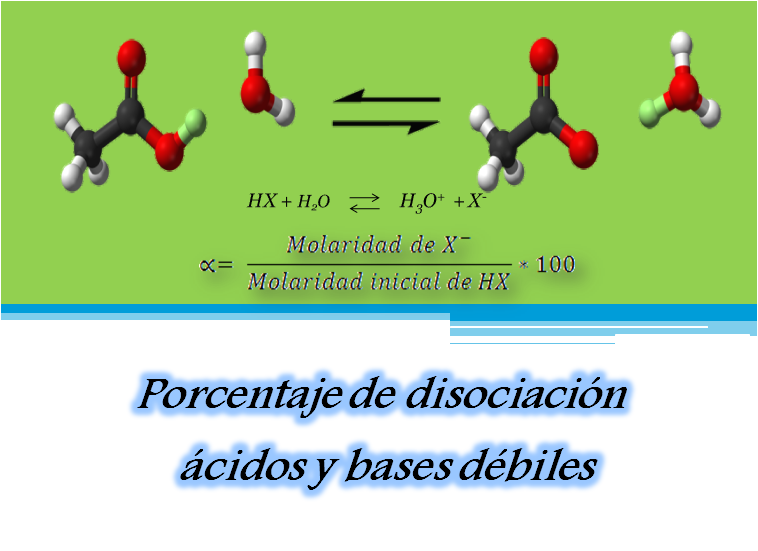
Imagen realizada en power point con imagen de dominio público 1
La gran mayoría de los ácidos son débiles, un ejemplo común y muy abundante es el ácido málico cuya fórmula química es C4H6O5, constituyendo el ácido principal presente en muchas frutas entre ellas cerezas, uvas, duraznos, peras y es quien le otorga la acidez a las manzanas verdes.

Imagen realizada en power point con imágenes de dominio público1,2,3,4
Por otra parte entre las bases débiles se encuentra la anilina, un compuesto orgánico con fórmula molecular C6H5NH2, que se utiliza en la fabricación de barnices, explosivos, pigmentos, en la industria farmacéutica entre otros.
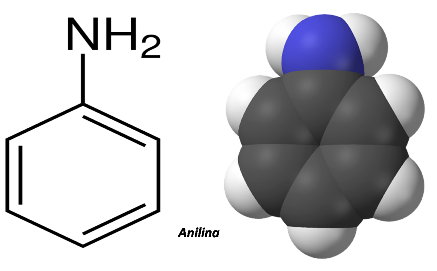
Estructura de la anilina. Imagen realizada en power point con imágenes de dominio público1,2
Ahora bien revisemos en primer lugar la disociación de los ácidos y bases débiles. Un ácido débil (HX) en forma general se disocia según la siguiente reacción de equilibrio
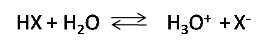
Dicha reacción muestra que en una disolución acuosa una cantidad significativa de HX queda sin disociarse, mientras que el resto del ácido se disocia en X- y H3O+
La constante de disociación (Ka) para este equilibrio viene dada por
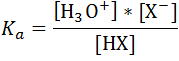
En el caso de las bases débiles de igual forma no se disocian completamente y la solución acuosa resultante contiene iones OH- y el catión correspondiente por lo que queda una gran cantidad de moléculas no disociadas de la base.
Como la disociación no es completa, una forma de conocer cuantitativamente la fuerza de un ácido o una base débil es por medio de la determinación de su protonación porcentual o porcentaje de disociación (α), en el caso descrito anteriormente se calcula el porcentaje de moléculas de ácido HX que se disocian en la solución.
Partiendo de la estequiometría de la reacción
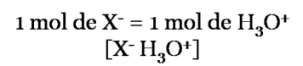
La ecuación del porcentaje de disociación viene dada por
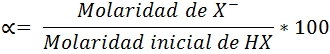
Donde:
[HX]inicial = concentración molar inicial del ácido tomando en consideración que no ocurrió disociación.
De esta ecuación se deduce que un bajo porcentaje de protonación indica que el soluto consiste en su mayoría del ácido HX siendo las concentraciones de H3O+ y X- bajas. De la misma forma se puede estudiar la fuerza de las bases débiles.
Si se comparan por ejemplo disoluciones 0.10M de CH3COOH, HOCl y HCl, se puede inspeccionar el valor de sus constante de disociación y se puede deducir que el CH3COOH se ioniza el 1.3%, mientras que el HOCl se ioniza el 0.059% y el HCl se ioniza casi en su totalidad, esto quiere decir que tanto el CH3COOH como el HOCl en disoluciones diluidas se presentan en su mayoría como molécula no disociada y hay poco iones H3O+ y los aniones correspondientes indicando así la fuerza de cada ácido y la diferencia entre ácidos fuertes como el HCl y ácidos débiles.

Tabla realizada con datos tomados Whitten
De lo anteriormente descrito se deduce que para el cálculo del pH y del porcentaje de disociación de un ácido o una base débil se puede partir del cuadro de equilibrio, lo que permite determinar la concentración de H3O+ y por medio de la constante de disociación bien sea Ka o Kb.
Aplicación cuantitativa
Estudiemos a continuación algunos ejemplos para el cálculo del pH y del porcentaje de disociación para ácidos débiles los cuales se pueden emplear en el tratamiento de bases débiles.
Caso 1
Cálculo del pH y el porcentaje de disociación de un ácido débil_
En este caso se tomará como ejemplo el ácido acético o vinagre comercial el cual es el principal responsable de su sabor y olor agrio característico. Su fórmula química es CH3COOH.Se tiene una solución de ácido acético 0.25 M y su constante de disociación es 1.8*10-5 determinar su pH y porcentaje de disociación.
- La reacción de disociación es
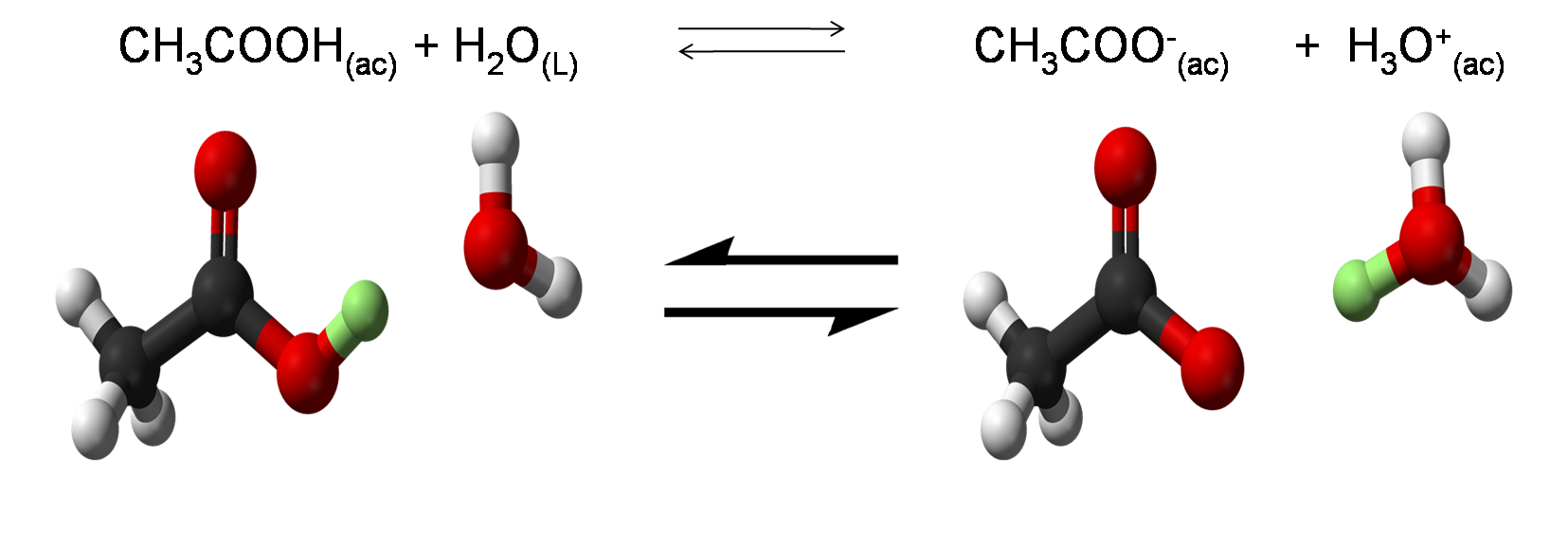
Imagen realizada con imagen de dominio público1
- Cálculo de las concentraciones de H3O+ en el equilibrio

- Expresión de la constante de disociación ácida
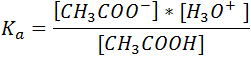
Sustitución de valores en Kc
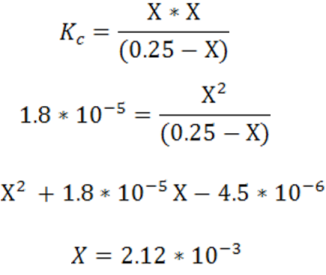
Cálculo del pH y el porcentaje de disociación
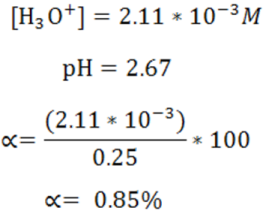
Caso 2.
Cálculo de la constante a partir del porcentaje de disociación
En este caso se trabajará con un una disolución de ácido HA 0.01M que se ioniza 2.1%
La reacción de disociación es
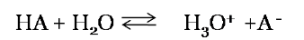
Expresión de la constante de disociación ácida
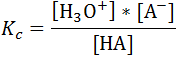
Calculo de [H3O+] a partir del porcentaje de disociación
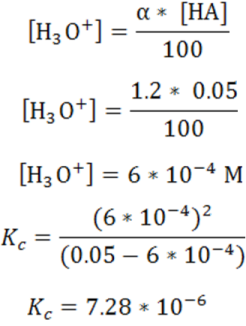
Como vemos los ácidos y bases débiles se disocian parcialmente por lo que resulta importante determinar el porcentaje de moléculas que quedan sin disociar lo que aporta información sobre su fuerza acida o básica y se deben conocer los fundamentos para su cálculo.
Hasta aquí el presente post, espero la información les sea útil, gracias por leer
Referencias
[1]. Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
[2]. Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Thank you!
I used to love this part in the chemistry classes! How to calculate PH and etc
!1UP
Certainly this part of chemistry is very interesting and has many practical applications. Thanks for reading!
You have received a 1UP from @gwajnberg!
@stem-curator
And they will bring !PIZZA 🍕.
Learn more about our delegation service to earn daily rewards. Join the Cartel on Discord.
Thank you!
I gifted $PIZZA slices here:
@curation-cartel(2/20) tipped @yusvelasquez (x1)
Please vote for pizza.witness!
Congratulations @yusvelasquez! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s):
Your next target is to reach 24000 upvotes.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPSupport the HiveBuzz project. Vote for our proposal!
Thank you!
You're welcome @yusvelasquez, it's well deserved! Congrats on your constant involvement on Hive 😊👍