Estudio de los pares conjugados de ácidos y bases
Hola estimados amigos!
¡Les invito a leer!
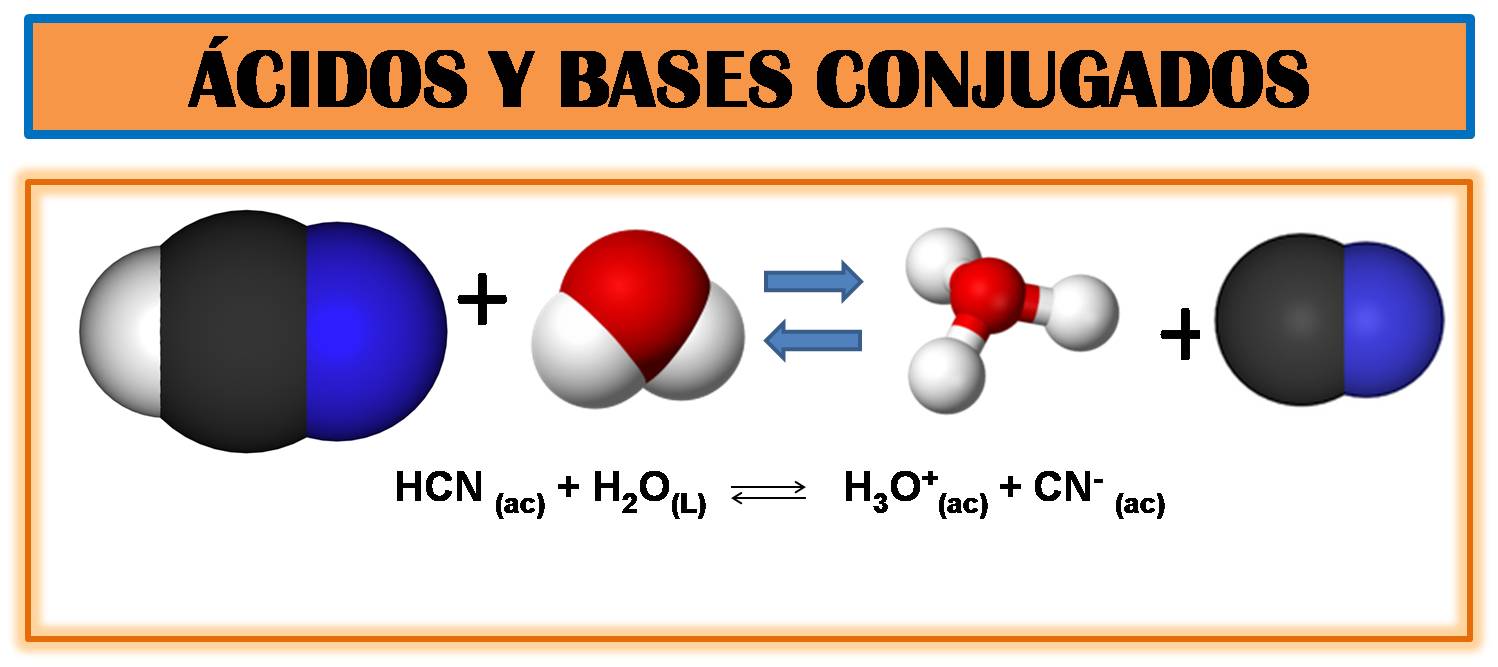
Imagen realizada en power point con imágenes de dominio público1, 2,3,4
Comencemos por recordar, que según la teoría de Bronsted- Lowry un ácido se define como un dador de protones, mientras que la base es la especie que acepta protones, refiriéndonos a protón como el ion hidrógeno H+.
Por ejemplo, el HCN dona su protón al agua y la transferencia se representa por la siguiente reacción:
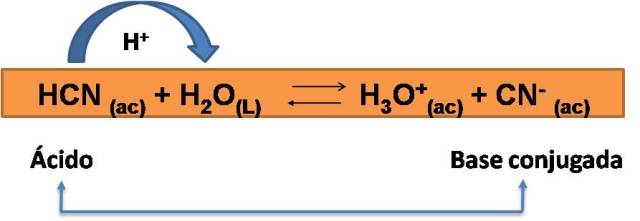
El producto de la reacción puede reaccionar también con el agua. En este caso el ion CN- puede también aceptar un protón de una molécula de agua, y formar nuevamente el HCN, entonces, basados en las definiciones de Bronsted- Lowry el ion CN- correspondería también a una base, recibiendo así el nombre de base conjugada del HCN. Veamos esta reacción:
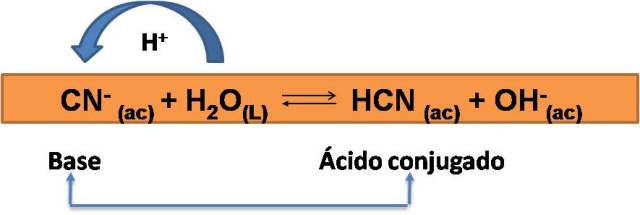
Podemos entonces concluir que una base conjugada es la especie que se forma cuando un ácido dona un protón
Ya que el HCN es el ácido que se forma cuando se le transfiere un protón al ion cianuro, se forma así el ácido conjugado. Entonces, el ácido conjugado es la especie que se forma cuando una base acepta un protón.
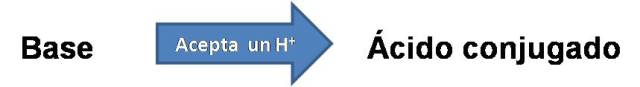
Por otra parte resulta importante conocer el grado con que el ácido por ejemplo dona el protón, si es fuerte o débil, ya que un ácido fuerte se desprotona completamente en solución, y uno débil lo hace parcialmente, de igual manera sucede con las bases fuertes y débiles.
En función a esto, podemos analizar que cuando se trate de un ácido fuerte, su base conjugada, va a resultar un débil aceptor de protones, en caso contrario cuando se trate de un ácido débil su base conjugada será fuerte en aceptar protones. También sucede algo similar con las bases.
Se concluye entonces, que mientras más fuerte sea el ácido más débil será su base conjugada y mientras más débil es la base, más fuerte es su ácido conjugado.
Expresión de la relación entre un par ácido /base conjugado
Continuemos con el ejemplo del HCN. Para este ácido se puede expresar su constante como:
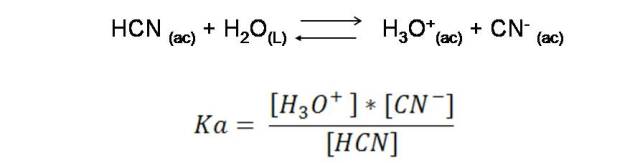
Para el equilibrio de la aceptación del protón, su constante viene dada por:
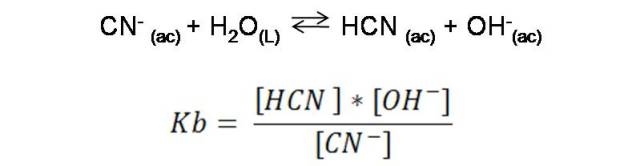
Si se multiplican las dos constantes se tiene
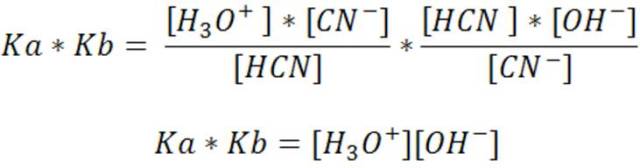
También se puede escribir como
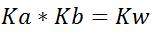
Muy importante recordar que esta ecuación se puede emplear solo para un par ácido base conjugado.
Cálculos empleando la relación Ka y Kb
Si se desea calcular por ejemplo la constante del CN-, la constante Ka en esta ecuación, es la constante del ácido débil, HCN y Kb es la constante de basicidad de la base conjugada de dicho ácido CN-.
El cálculo viene dado por:
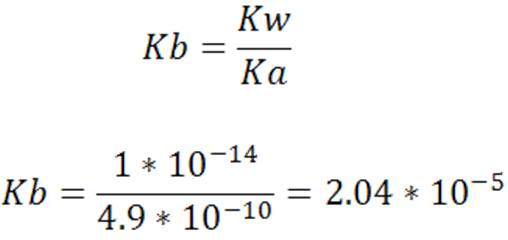
Entonces vemos como partiendo de la relación Kay Kb se pueden calcular las contantes de iones ácidos o basicos.
Fuerza de los pares de ácido y base conjugados
De la expresión de la relación entre un ácido y su base conjugada podemos deducir que si la constante Ka de un ácido es muy alta, entonces el Kb de su base conjugada debe ser muy bajo. De forma similar si una base posee una constante Kb muy alta, su ácido conjugado debe tener una constante Ka muy baja, por lo que existe una relación inversa y se puede observar en la siguiente figura:

Imagen elaborada en power point con datos tomados de Atkins (2006).
La importancia del dominio del conocimiento de la fuerza de los ácidos y bases así como también del cálculo de las constantes de los iones ácidos o básicos resulta importante en el estudio del equilibrio iónico, en especial cuando se trata de hidrólisis de sales y soluciones amortiguadoras.
¡Espero que la información presentada les sea muy útil, gracias por leer, hasta una próxima oportunidad!
Referencias
• Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana
• Atkins, P. y Jones, L. (2006). Principios de Química. Los caminos del descubrimiento. Buenos Aires: Médica Panamericana
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.