Estudio de la precipitación selectiva o fraccionada. Aplicaciones
¡Hola estimados amigo!
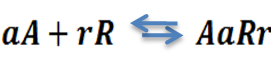
En la precipitación se adiciona un agente precipitante que reacciona con el analito, formando un compuesto que posteriormente se separa, se lava, se filtra y seca para determinar así cuantitativamente su composición.
Sin embargo, cuando en una muestra se encuentran diferentes especies con propiedades similares es posible separarlas una a una mediante la adición de un compuesto soluble que forma compuestos poco solubles con todos, empleando para ello La Precipitación Fraccionada, el cual les invito a leer para conocer más acerca de sus principios y aplicaciones.

Fuente: @yusvelasquez
Por ejemplo, si se tiene una muestra que contiene iones Cl-, Br-, I- veremos que a pesar de que tienen propiedades similares, es posible su separación.
Principio del método
Ahora bien, ¿Cómo se logra la separación? Esta separación se logra cuando existe diferencia en las solubilidades de las especies que se desean separar, adicionalmente debe cumplirse que el Qps sea mayor al Kps de una especie pero menor al Kps de la otra especie a separar.
Básicamente el proceso es como se muestra a continuación, tomando como ejemplo la muestra que contiene iones Cl-, Br-, I-
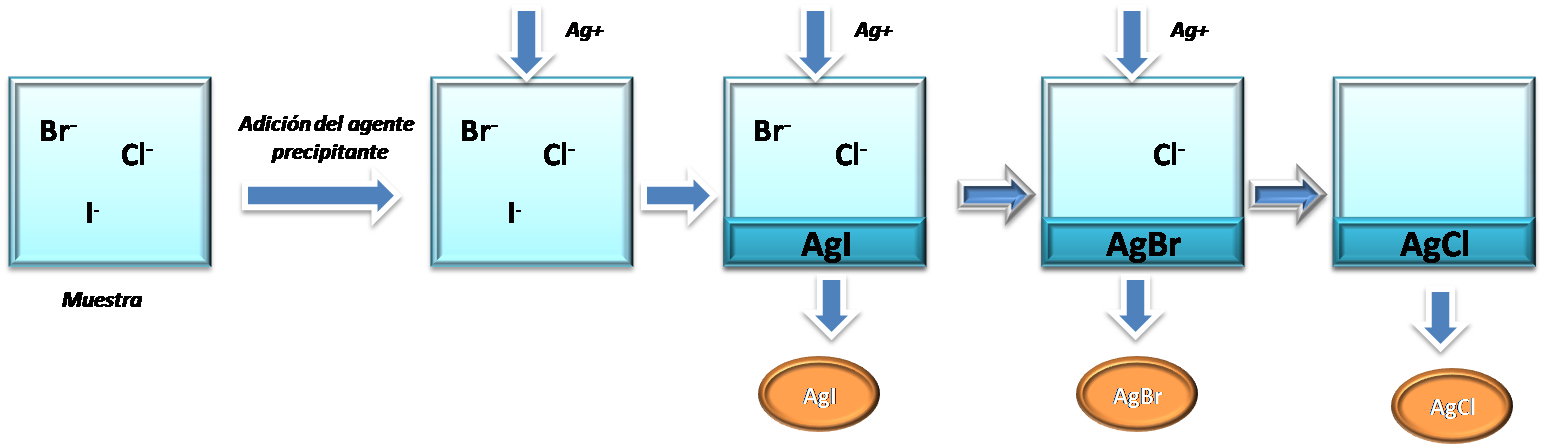
Fuente:@yusvelasquez
En este caso los valores correspondientes de los Kps para cada compuesto son:
AgBr Kps = 3.3 * 10-13
AgI Kps = 1.5* * 10-16
Al comparar los 3 valores se puede observar que el yoduro de plata es el compuesto menos soluble por poseer el valor mas bajo de Kps, seguido del bromuro de plata y finalmente el cloruro de plata es el más souble por lo que se separa al final del proceso.
Cálculos aplicados en la precipitación fraccionada
Veamos el siguiente ejemplo:
Una muestra de mar contiene varios iones, entre los que se encuentra Mg+2 con una concentración de 0.025mol/L, y Ca+2 con una concentración de 5*10-3mol/L. Si se adiciona NaOH como agente precipitante: Determínese cual ion precipita primero y cuál será la concentración del OH- que se requiere para lograr la precipitando de cada ion.
Paso 1: Comencemos por escribir la reacción de formación de cada precipitado formado al adicionar el NaOH y su respectiva constante (Kps)
En el caso del ión Mg+2
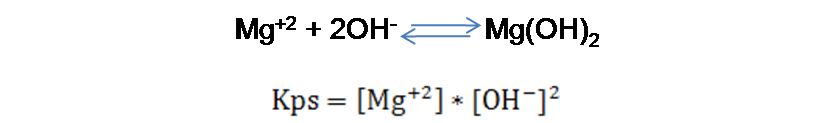
El valor del Kps para el Mg(OH)2 es 1.1*10-11 según la bibliografía consultada [1].En el caso del ión Ca+2
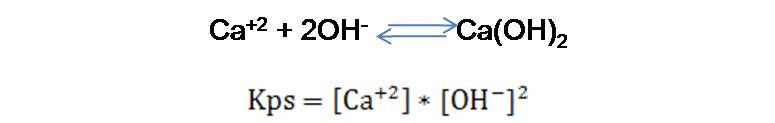
El valor del Kps para el Ca(OH)2 es 5.5*10-6 según la bibliografía consultada [1].
Paso 2 : Se determina la concentración del agente precipitante, en este caso OH- para lograr la precipitación de cada ion.
- Para el caso del Mg(OH)2
Partiremos de la expresión de Kps y su valor
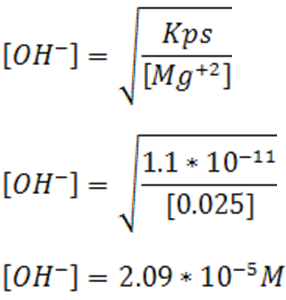
- Para el caso del Ca(OH)2
De igual forma para el cálculo se parte de la expresión de Kps y su valor
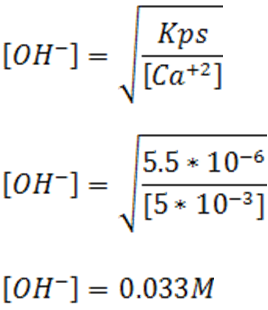
Si observamos los valores de las concentraciones requeridas de OH- se puede concluir lo siguiente:
Primero precipitará el Mg(OH)2 y después del Ca(OH)2 ya que para el ion magnesio se requiere adicionar menor concentración del agente precipitante, si se observan también los valores del Kps de cada compuesto, nos proporciona información relacionada con sus solubilidades, siendo mayor la del hidróxido de calcio por lo que esta sal es mas soluble que el hidróxido de magnesio por lo que es más fácil la separación de este último compuesto.
Aplicación industrial
Un ejemplo de la aplicación de la precipitación fraccionada se puede observar en el tratamiento de efluentes mineros que contienen entre otros residuos metales disueltos como aluminio, hierro, cobre, magnesio, zinc entre otros, y que cuya concentración elevada resultan dañinos al ambiente. La eliminación se puede realizar empleado el NaOH como agente precipitante y estableciendo las variables para lograr una separación cuantitativa de los metales.
Esta técnica, por ejemplo, fue la empleada en un estudio realizado en España para tratar efluentes mineros, específicamente diseñado para la separación del Fe, Al y Cu ya que correspondían a los metales que estaban presentes en mayor concentración. El diseño básicamente consistía en un sistema conformado por dos reactores colocados en series, para llevar a cabo las neutralizaciones respectivas, y cada uno contaba a la vez con una salida para la recolección de los hidróxidos formados. En primer lugar se logró la separación del Fe como hidróxido de hierro, seguido de la separación del Al en forma de hidróxido de aluminio, quedando así Cu en el efluente [3].

Fuente: wikipedia.com
Como vemos la precipitación fraccionada se da en varias etapas dependiendo del número de especies que se van a separar y que se puede aplicar fácilmente si se desea separar analitos que posean diferencias en sus solubilidades por medio de un control en la adición del agente precipitante y una correcta selección de mismo.
¡Gracias por leer, espero la información les sea de gran utilidad. Hasta una próxima oportunidad!
Referencias consultadas
[1] Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
[2] Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editorial Interamericana.
[3] Diseño de un proceso de precipitación fraccionada y la implementación de su sistema para el control de pH para la recuperación de metales en un efluente minero. Disponible en línea
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!