Estudio de la constante de equilibrio en función a presiones parciales
¡Hola estimados amigos!
A continuación describiré como se puede expresar Kp y la relación existe con Kc.
¡Les invito a leer!
 Fuente: @yusvelasquez
Fuente: @yusvelasquez
¿Cómo se expresa Kp?
Si se tiene por ejemplo una reacción escrita en forma general como la que sigue:

La expresión de Kp viene dada por:
Como se puede observar, la constante Kp sigue la misma forma que Kc, los productos van en el numerador y los reactivos en el denominador y cada especie se eleva al coeficiente estequiométrico que lo acompaña en la ecuación química balanceada, sólo que en este caso se emplean las presiones parciales en el equilibrio.
Veamos el siguiente ejemplo:
 Fuente:@yusvelasquez
Fuente:@yusvelasquezPara la reacción de descomposición del PCl5 la expresión de Kp viene dada por:

Consideremos ahora la relación que existe entre Kc y Kp
Existe una expresión que relaciona ambas constantes. A continuación veamos su deducción:
Si partimos de la ecuación de gas ideal:
Se puede observar que la presión de un gas es directamente proporcional a su concentración (n/V) por lo que se puede expresar K en función a las presiones parciales en un equilibrio.
Continuaremos con la reacción general:

Sustituiremos la expresión de presión parcial en la expresión de Kp
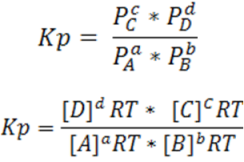
Se reordenan los términos
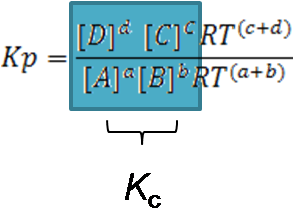
Se puede observar que las concentraciones se pueden agrupar en la expresión de Kc
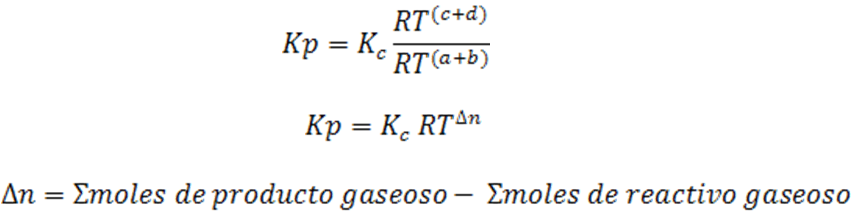
Si analizamos bien la expresión se puede observar que:

Por lo que es muy importante que la ecuación química esté correctamente balanceada.
Veamos el siguiente ejemplo:
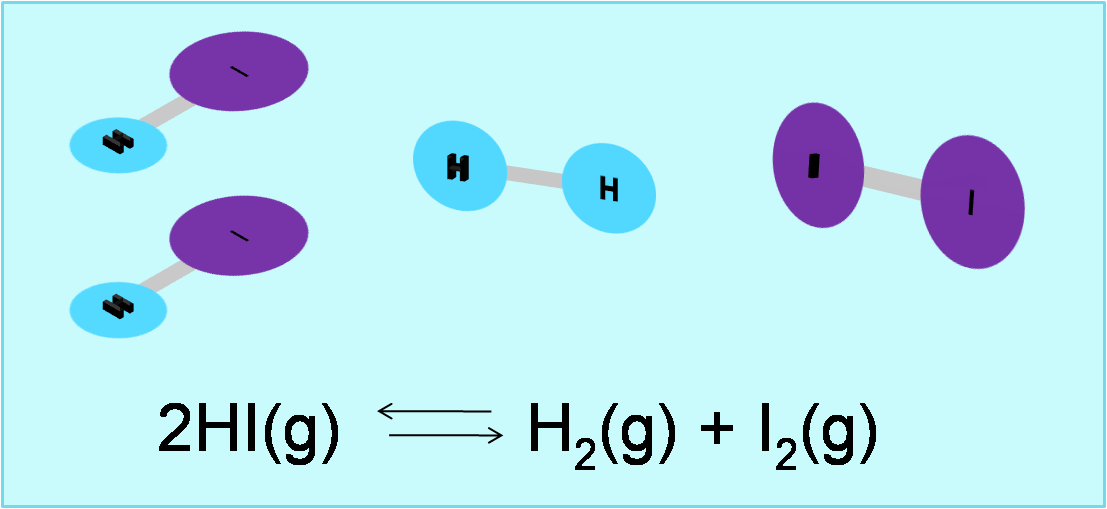 Fuente:@yusvelasquez
Fuente:@yusvelasquezComo observamos ya la reacción está balanceada. Del lado de los productos se tienen 2 moles gaseosos y del lado de los reactivos 2 moles gaseosos.
Para esta reacción ∆n se calcula de la siguiente forma:
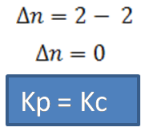

Otro aspecto importante a considerar es la relación que podemos establecer entre Kc y Kp para el cálculo de concentraciones y presiones.
Por ejemplo, ¿Cómo calcular Kp y presiones en el equilibrio a partir de concentraciones ?
Veamos el siguiente ejemplo:

Las concentraciones en el equilibrio son:
[I2]= 2.4 *10-4
[HI]=1.76 *10-3
En este caso podemos dar respuesta a la pregunta planteada en primer lugar calculando Kc con las concentraciones en el equilibrio, seguidamente podemos hacer uso de la relacion Kp y Kc para calcular Kp y finalmente con las concentraciones en el equilibrio, la constante de los gases y la temperatura se pueden calcular las presiones en el equilibrio.
A continuación se muestran los cálculos involucrados:

Este es un ejemplo de que a partir de las concentraciones se puede calcular Kp y presiones, también se puede trabajar de forma inversa partiendo de las presiones y Kp por lo que se pueden resolver variedad de ejercicios.
Entre las conclusiones más destacadas se puede hacer referencia a la importancia de trabajar con la expresión de Kp en el caso de mezclas gaseosas ya que la presión se puede medir directamente, así como tambien la importancia del conocimiento de la relación entre Kp y Kc y la ley de los gases para la conversión de presiones a concentraciones y viceversa.
¡Hasta aquí por los momentos. Espero les sea muy útil el contenido desarrollado, gracias por leer!
Referencias
• Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
• Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana.
Congratulations @yusvelasquez! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s):
Your next target is to reach 17000 upvotes.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPTo support your work, I also upvoted your post!
Check out the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more
Thank you!