Estudio de la autoionización del agua
!Hola amigos!
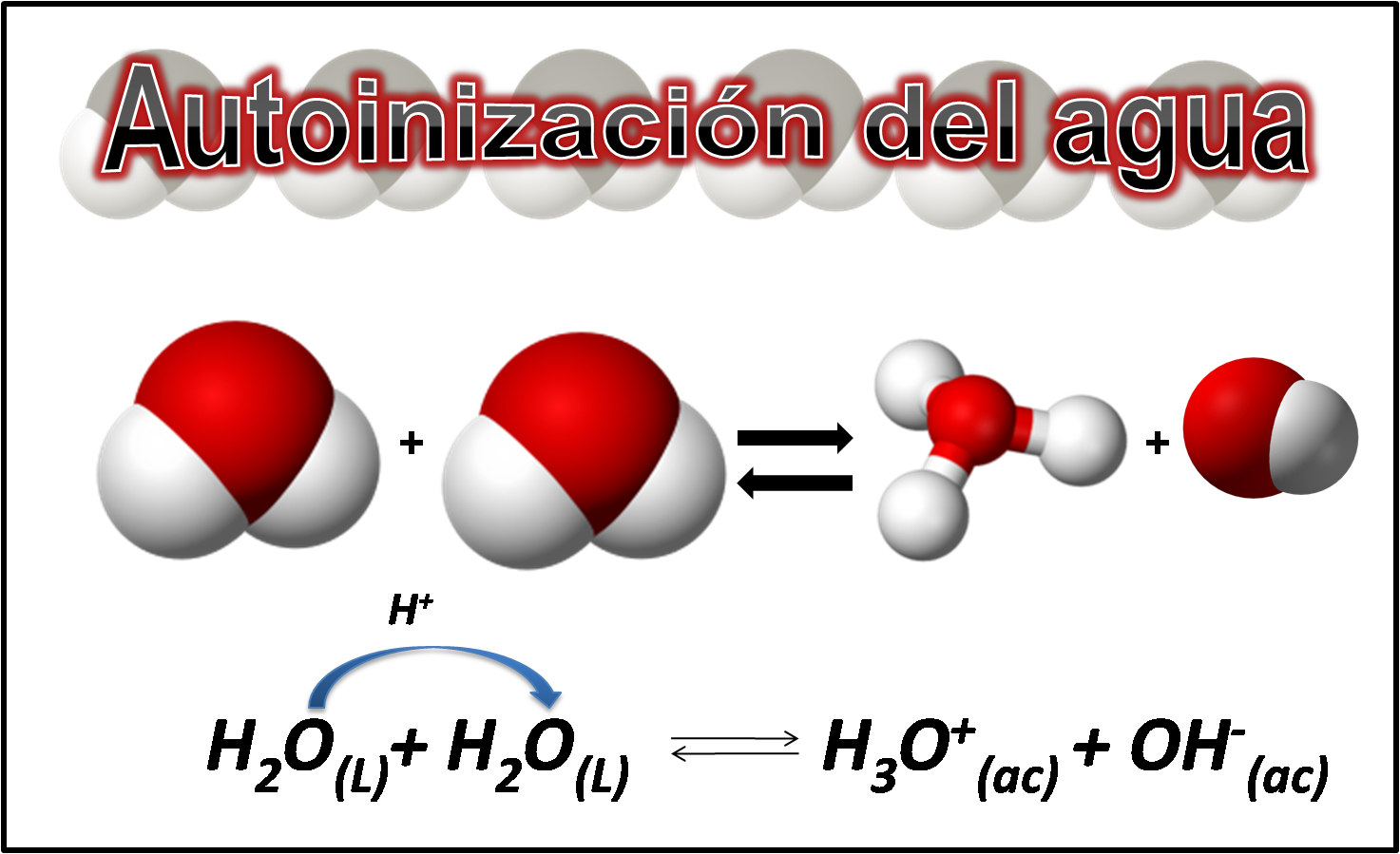
Fuente: imagen realizada en power point con imágenes de dominio público:1,2,3
La autoionización del agua se puede comprender mejor si nos basamos en las definiciones de ácidos y bases según la teoría de Bronsted y Lowry, donde un ácido se define como toda sustancia capaz de ceder electrones y una base como toda sustancia capaz de aceptarlo. Veamos las siguientes reacciones:
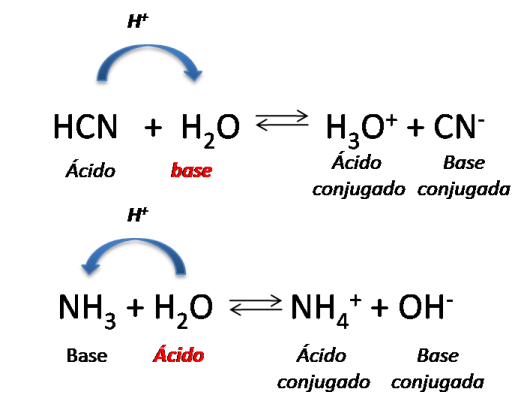
Como se puede observar en la reacción de disociación del ácido cianhídrico (HCN) el agua actúa como una base, ya que acepta un protón y en la disociación del amoníaco (NH3) el agua actúa como un ácido, ya que cede un protón, es así como también dicha teoría incluye la existencia de sustancias anfipróticas, que son aquellas que pueden actuar como ácido y como base. Un ejemplo, es el agua.
Es así como la reacción entre una molécula de agua que transfiere un protón con otra molécula de agua que lo acepta se conoce como autoprotólisis y se escribe de la siguiente manera:
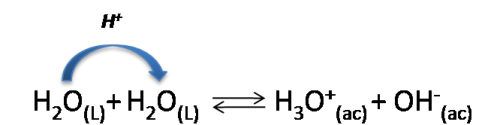
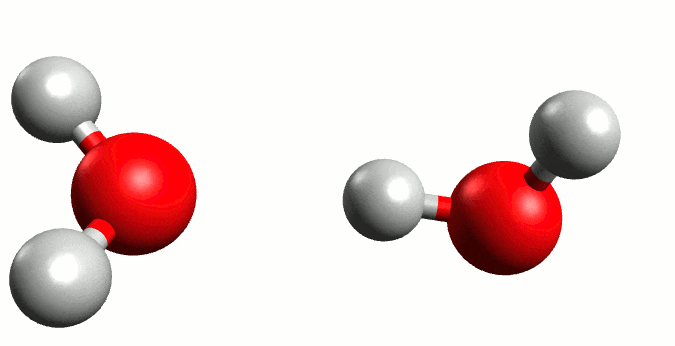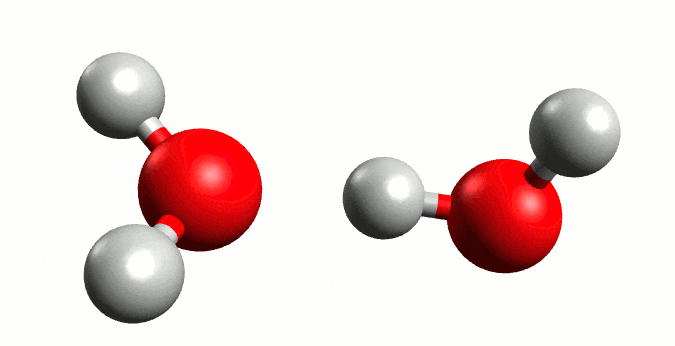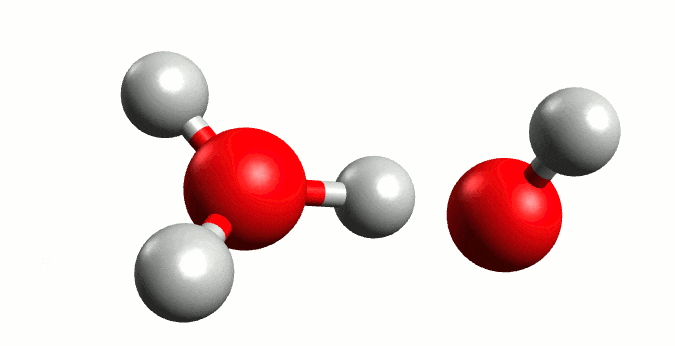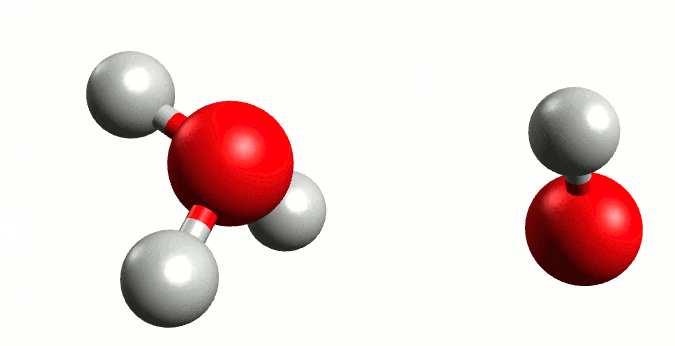
Autoionización del agua. Fuente:wikipedia.org
El agua es una molécula que se encuentra unida por fuertes enlaces de hidrógeno, por lo que el hidrógeno de una molécula puede ser atraído por un par de electrones no compartidos del oxígeno de otra molécula de agua cercana, y a veces puede ser transferido a la otra molécula. A su vez puede ocurrir que se dé una transferencia de H+ de otra molécula hacia el oxígeno de ésta perdiendo un ion H+, por lo que una fracción pequeña de la molécula se encuentra en forma ionizada, en esta reacción se produce un equilibrio entre la molécula no ionizada y los iones.

Fuente: Brown, T.
Esta reacción es muy rápida y reversible, ocurre en poca extensión, se da en el agua pura y está presente también en disoluciones acuosas. Para dicho equilibrio la constante se conoce como Kw constante de ionización o autoprotólisis del agua, y tiene la siguiente expresión:
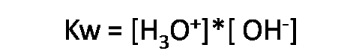
En agua pura a 25°C, la constante tiene un valor de 1*10-14, por lo que se tienen las siguientes concentraciones de H3O+ y OH-
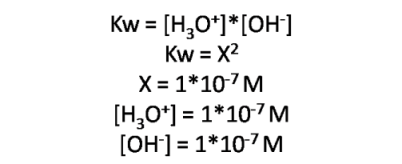
Ambas concentraciones son iguales, y su valor es 1*10-7mol/L. En agua pura, estas concentraciones son muy pequeñas, debido a ello conduce muy poco la electricidad siendo un electrolito débil.
Es muy importante memorizar esta expresión y su valor ya que es muy empleada en cálculos. En función a la relación entre la concentracion de H3O+ y OH- las soluciones pueden ser:

En las disoluciones ácidas la concentracion de H3O+ es mayor a la de OH- por lo que su valor será menor a 1*10-7, en el caso de las soluciones básicas ocurre lo contrario el valor de OH- será mayor a 1 * 10-7.
Aplicación cuantitativa
Como vemos a partir de la expresión de Kw se puede calcular la concentración de H3O+ y OH-.
Calculemos la concentración de H3O+ en una solución cuya concentración de OH- es 0.005M.
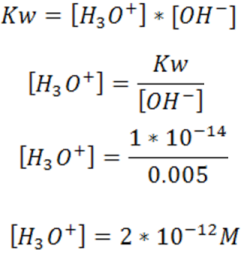
Como se observa en esta disolución la concentración de OH- es mayor a la de H3O+ por lo que se tiene una solución básica.
Calculemos la concentración de H3O+ y OH- en una solución de Ba(OH)2 0.015M a 25°C.
En este caso el hidróxido de bario es una base fuerte, por lo que se disocia completamente y está presente en el agua como iones OH- y Ba+2 , por lo que a partir de la reacción se puede determinar cuántos OH- se tienen.
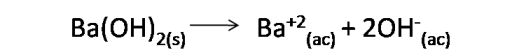
Basados en la estequiometría de la reacción se deduce que la concentración de OH- es el doble de la concentración de Ba(OH)2.
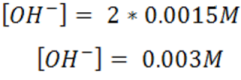
A partir de la concentración de OH- y la Kw se puede calcular entonces la concentración de H3O+.
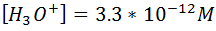
En este caso la concentración de OH- es mayor a la de H3O+ por lo que la solución es básica.
Cómo se observa resulta importante estudiar la reacción de autoprotólisis del agua, y emplear su constante ya que ella relaciona la concentración de H3O+ y OH-, siendo base para el estudio cuantitativo del pH y pOH de una solución, constituye una de las expresiones más valiosa que se ha deducido en el área de química.
¡Bueno amigos, espero la información presentada les sea de gran utilidad, gracias por leer!
Referencias
• Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
• Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Felicitaciones!
Estás participando para optar a la mención especial que se efectuará el domingo 5 de junio del 2022 a las 8:00 pm (hora de Venezuela), gracias a la cual el autor del artículo seleccionado recibirá la cantidad de 1 HIVE transferida a su cuenta.
¡También has recibido 1 ENTROKEN! El token del PROYECTO ENTROPÍA impulsado por la plataforma Steem-Engine.
1. Invierte en el PROYECTO ENTROPÍA y recibe ganancias semanalmente. Entra aquí para más información.
2. Contáctanos en Discord: https://discord.gg/hkCjFeb
3. Suscríbete a nuestra COMUNIDAD y apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
4. Visita nuestro canal de Youtube.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Una basica informacion! Grato!
!1UP
You have received a 1UP from @gwajnberg!
And they will bring !PIZZA 🍕
Learn more about our delegation service to earn daily rewards. Join the family on Discord.