Estudio cualitativo de los electrólitos y no electrólitos
¡Hola amigos!

Fuente: @yusvelasquez
Los solutos en una solución pueden estar presentes bien sea como iones o como moléculas, en función a ello se puede distinguir entre Electrólitos y No electrólitos.
Comencemos por estudiar los Electrolitos
En esta categoría se incluyen a todas aquellas sustancias que se disuelven para formar soluciones que conduce la electricidad, tal como su nombre lo indica. Cuando el sólido iónico se disuelve, no se forman los iones que conducen la electricidad, ya ellos existen como iones separados en el sólido y en presencia del agua tienen libertad para moverse.
En el caso por ejemplo, del cloruro de sodio o sal común, que está formado por iones Na+ e iones Cl- , al disolverse en agua, estos iones se separan y se dispersan por el solvente, por lo que la solución consta de moléculas de agua, y de estos iones ya que todo el cloruro se disuelve. Si se tiene una solución 1M de NaCl, esto significa que contiene 1mol de Na+ y 1mol de Cl- por litro de disolución.
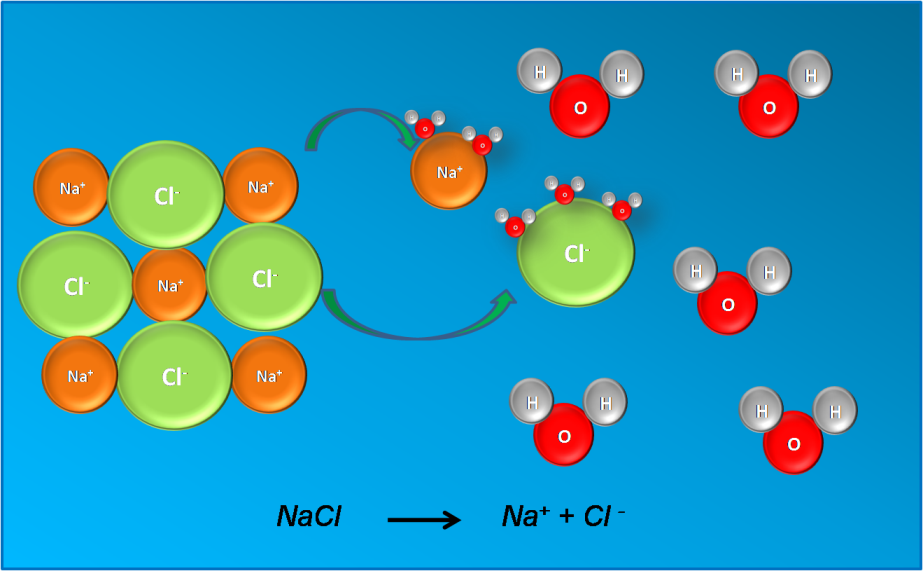
Disociación del cloruro de sodio en agua. Fuente: @yusvelasquez
Entre los electrólitos podemos encontrar también el nitrato de potasio KNO3, NaNO3, KCl, NaOH entre otros.
Los ácidos aunque son compuestos moleculares, forman iones cuando se disuelven, esto se debe a que contienen enlaces altamente polares. Por ejemplo, el HCl, se disuelve en agua formando una disolución acuosa de ácido clorhídrico, en solución existe completamente como iones H+ e iones Cl-.
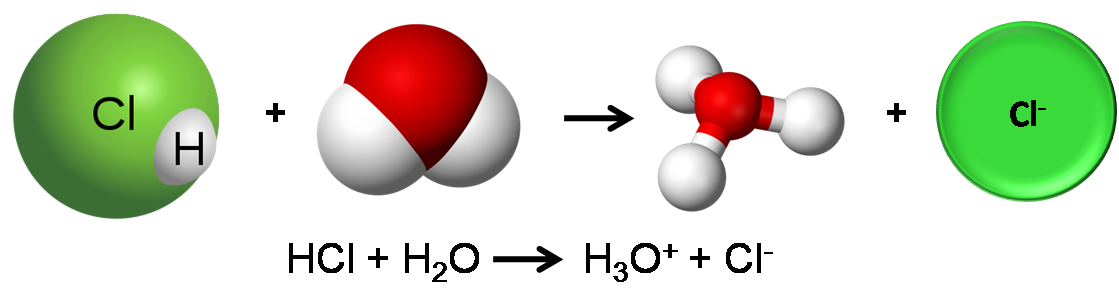
Disociación del ácido clorhídrico. Fuente: Imagen realizada en power point con imágenes tomadas de:1, 2,3
Así se tienen también el ácido acético, el ácido cianhídrico, HgCl2 entre otros.
Los electrólitos pueden ser fuertes o débiles. Se consideran fuertes cuando el soluto está presente en la solución casi completamente como ion. Entre ellos se encuentran el cloruro de sodio, HCl, HBr, HI.
Por el contrario los electrólitos débiles, se ionizan de forma incompleta en la solución, por lo que la mayor parte se encuentra como molécula no ionizada. Entre algunos ejemplos se tiene el acido acético CH3COOH, HCN.
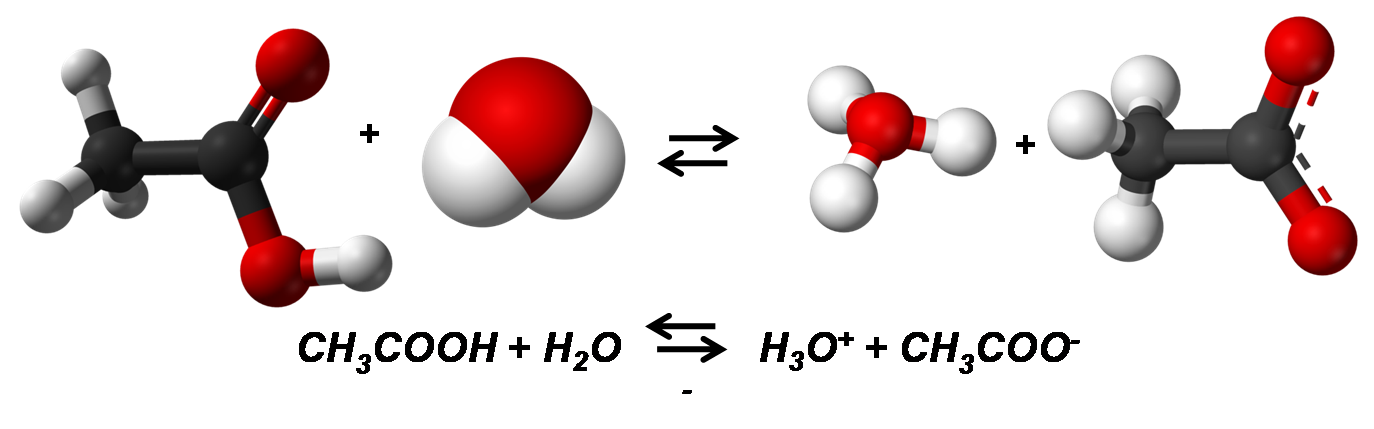
Disociación del ácido acético. Fuente: Imagen realizada en power point con imágenes tomadas de:1,2,3,4
La fuerza de los electrólitos se puede medir por su capacidad de conducir la corriente eléctrica, es así como un electrólito fuerte es mejor conductor que un electrólito débil.
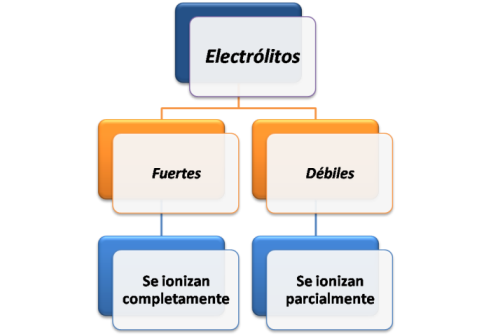
Tipos de electrólitos. Fuente:@yusvelasquez
Una forma sencilla de comprobar de forma experimental si se trabaja con una disolución electrolítica es a través del montaje que se muestra a continuación, donde se utiliza la disolución para completar un circuito eléctrico, ya que si existen iones en la solución y se completa el circuito se encenderá el bombillo, por lo que se estará en presencia de un electrólito.
En este caso se trabajó en primer lugar con agua, como se observa no se encendió el bombillo, esto debido a que el agua pura es un mal conductor ya que existen muy pocos iones.

Montaje del circuito con agua pura. Fuente: @yusvelasquez
Adicionalmente se trabajó con una solución de cloruro de NaCl obteniendose el siguiente resultado:

Montaje del circuito con una disolución de NaCl. Fuente: @yusvelasquez
Se empleó también el ácido acético CH3COOH. Como se puede observar en la imagen, con el cloruro de sodio y el ácido se encendió el bombillo, la diferencia radica en la intensidad, y esto se debe a las fuerzas de cada compuesto. El NaCl como se mencionó anteriormente es un electrólito fuerte y el ácido acético es un electrólito débil.

Electólito fuerte y débil. Fuente: @yusvelasquez
Un aspecto que se debe tomar en cuenta en el caso de electrolitos fuertes y débiles es lo relacionado a la solubilidad, ya que se pueden trabajar con compuestos ligeramente solubles como el cloruro de plata AgCl, y que al disolverse en agua parte quede como un sólido insoluble, sin embargo, la porción que se disuelve está completamente ionizada presente como iones Ag+ e iones Cl-, por lo que se incluyen dentro de la categoría de electrólitos fuertes.
En forma general, se pueden distinguir los electrolitos fuertes de los electrolitos débiles tomando en cuenta que la mayoría de las sales son compuestos iónicos fuertes. La mayor parte de los ácidos son electrólitos débiles, por lo que es más fácil dominar los fuertes más comunes entre los que se encuentran el HCl, H2SO4, HNO3, HBr, HClO4, HI y las bases fuertes las forman los hidróxidos de los metales alcalinos del grupo IA(Li, K, Na, Rb y Cs) y se incluyen también los de Ca, Sr y Ba.
No Electrolitos
Como su nombre lo indica, son sustancias que no se ionizan y no conducen la corriente eléctrica. Entre estas sustancias se encuentran la mayoría de los compuestos orgánicos como la glucosa, y el etanol, ellas mantienen sus estructuras moleculares en lugar de la ionización en la solución, se mantiene las moléculas intactas que se dispersan en las moléculas del solvente. En este caso a nivel experimental se pudo comprobar que la glucosa no conduce la corriente eléctrica.

No electrólito, disolución de glucosa. Fuente: @yusvelasquez
Como vemos, resulta importante distinguir entre los electrólitos y no electrólitos, así como también sus características especialmente para realizar los cálculos donde participan estas sustancias.
Por otra parte, en nuestro cuerpo es importante mantener el nivel de electrólitos, ya que ellos se encargan de transportar nutrientes a las células, equilibran el pH del cuerpo, equilibran la cantidad de agua en el cuerpo y se encuentran tanto en la sangre, en la orina u otros líquidos del cuerpo.
¡Bueno amigos, espero la información presentada les sea de gran utilidad, gracias por leer!
Referencias
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
- Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México
- Equilibrio hidroelectrolítico. Disponible en línea
!1UP
You have received a 1UP from @luizeba!
@stem-curatorAnd they will bring !PIZZA 🍕
Learn more about our delegation service to earn daily rewards. Join the family on Discord.
¡Enhorabuena!
✅ Has hecho un buen trabajo, por lo cual tu publicación ha sido valorada y ha recibido el apoyo de parte de CHESS BROTHERS ♔ 💪
♟ Te invitamos a usar nuestra etiqueta #chessbrothers y a que aprendas más sobre nosotros.
♟♟ También puedes contactarnos en nuestro servidor de Discord y promocionar allí tus publicaciones.
♟♟♟ Considera unirte a nuestro trail de curación para que trabajemos en equipo y recibas recompensas automáticamente.
♞♟ Echa un vistazo a nuestra cuenta @chessbrotherspro para que te informes sobre el proceso de curación llevado a diario por nuestro equipo.
Cordialmente
El equipo de CHESS BROTHERS
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.