Equilibrio Químico. Relación entre la expresión de la constante de equilibrio y la ecuación química
Dependiendo de la magnitud de la constante de una determinada reaccion a nivel industrial se pueden hacer cambios con la finalidad de mejorar los procesos y aumentar el rendimiento. Sin embargo, a veces no resulta muy sencilla la determinación de las concentraciones en el equilibrio y de las constante, por lo que en relacion a este ultimo, es posible establecer relaciones con otras reacciones para encontrar su valor.
En este post desarrollaré específicamente como expresar la constante de una reacción y las distintas relaciones que se pueden establecer entre las constantes de dstintas reacciones.
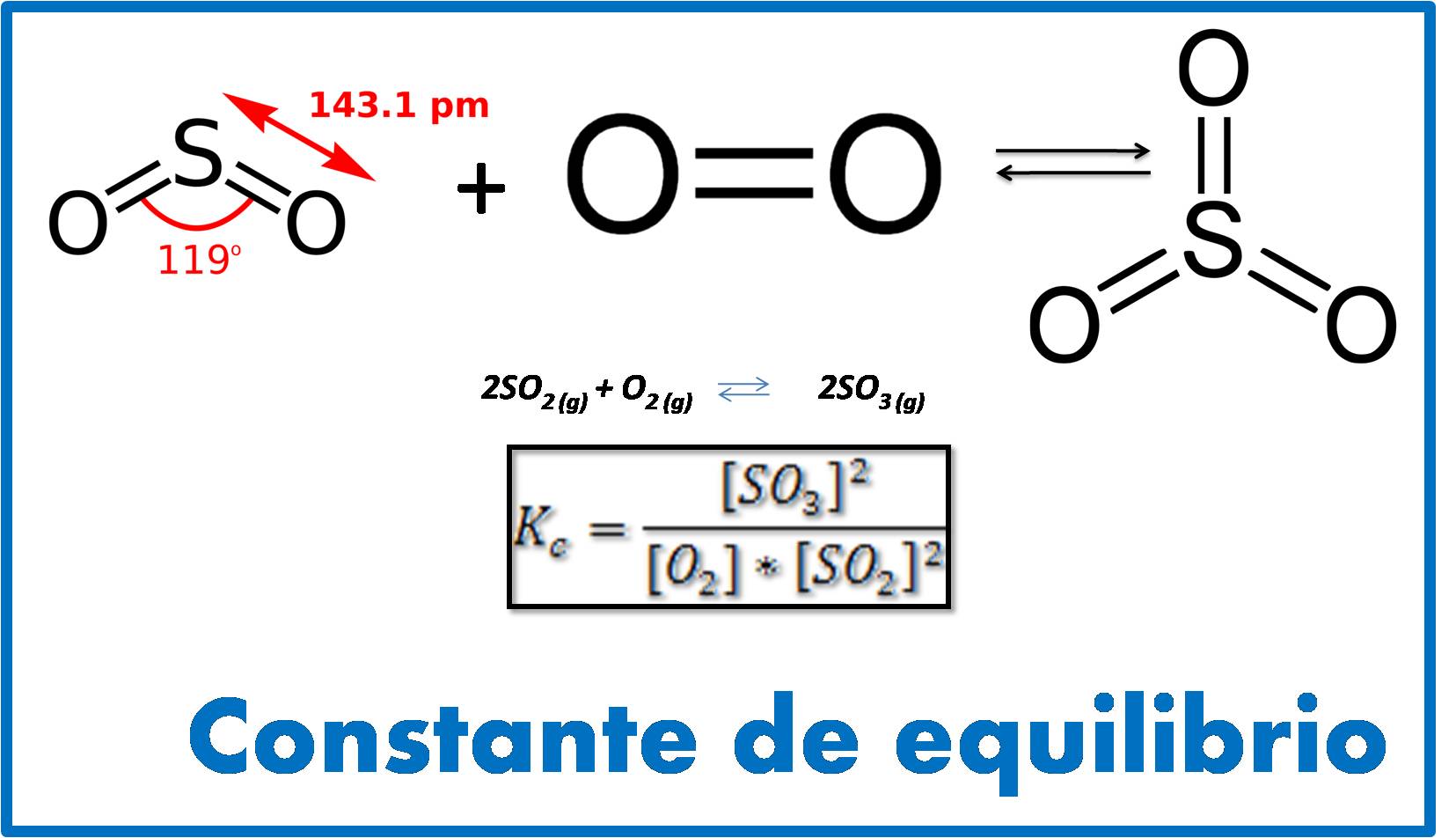
Imagen realizada en power point con imágenes de dominio público:1,2,3
Ahora bien, ¿Cómo se expresa la constante de equilibrio de una reacción?
Si se tiene la siguiente reacción reversible escrita en forma general

Por definición, el equilibrio se establecerá cuando la velocidad de la reacción directa se iguala a la velocidad de la reacción inversa.
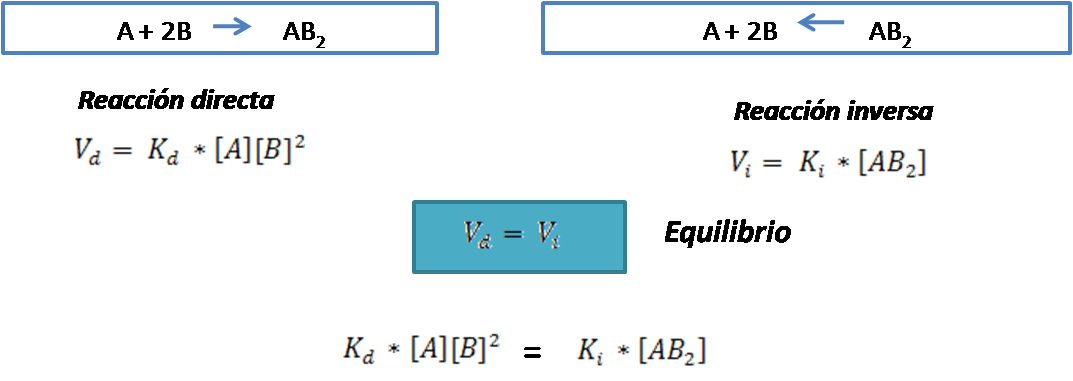
Al reordenar la expresión se tiene:
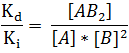
Como a cualquier temperatura Kd y Ki son constantes, a la relación Kd/ Ki se conoce como constante de equilibrio K o Kc, donde el subíndice se refiere a las concentraciones en el equilibrio expresadas en moles/L. Por lo que se puede escribir de la siguiente manera:
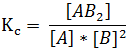
En forma general, para cualquier reacción la constante viene expresada como el producto de las concentraciones de los productos elevadas al coeficiente estequiométrico que los acompaña en la ecuación química balanceada divida entre el producto de los reactivos elevadas cada una a sus coeficientes. Por lo que se puede hacer uso de la siguiente expresión:
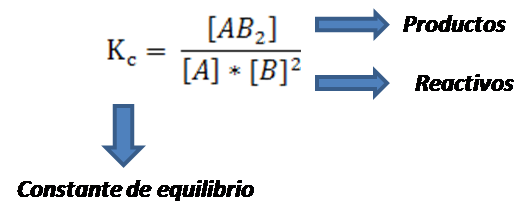
Expresión de la constante de equilibrio
Comencemos por expresar la constante de equilibrio para una determinada reacción química. Si por ejemplo se tiene la siguiente reacción donde el dióxido de azufre se combina con el oxígeno para formar trióxido de azufre:
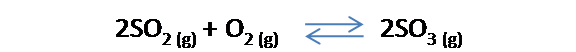
La expresión de Kc para esta reacción viene dada por:
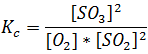
Su valor a 400°C es de 3.1*10-4
Relación entre otras reacciones químicas asociadas y su constante de equilibrio.

La constante de equilibrio para un equilibrio escrito en dirección opuesta es igual al recíproco de la constante de la reacción original.
Si se toma la reacción descrita anteriormente, denominada rección original y se escribe en sentido contrario, se tiene:

Para esta reacción la expresión de la constante viene dada por:
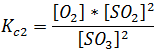
Si se establece la relación entre la reacción original y ésta, observaremos que es su inversa, los reactivos pasan a ser productos y el producto pasa a ser reactivo, se tiene entonces la siguiente expresión de la constante para esta reacción y su valor.
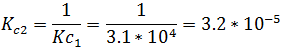

Si la ecuación química original se multiplica por un factor n, la expresión de la constante de equilibrio de la reacción se eleva a la potencia n
En este caso, si la ecuación original se multiplica por un factor igual a 2, se tiene:
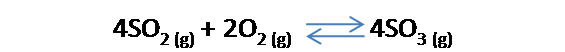
Entonces, su constante viene dada por:
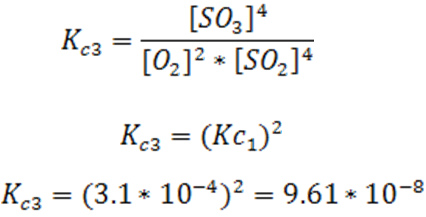
Cabe destacar que para establecer las relaciones entre las ecuaciones químicas deben ser las mismas especies que participan en la reacción.

La constante de equilibrio para una reacción que es producto de la suma de dos o más reacciones, es el producto de las constantes de las reacciones que la componen.
En este caso veamos el siguiente ejemplo, donde la reacción 3 es producto de la suma de la reacción 1 y 2 y su constante se expresa en función a las constantes de ambas reacciones.
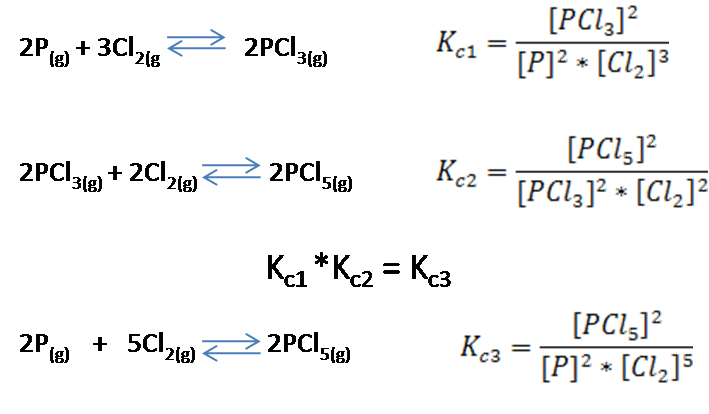
Finalmente se muestra a continuación una tabla resumen con los casos estudiados para una mejor comprensión.
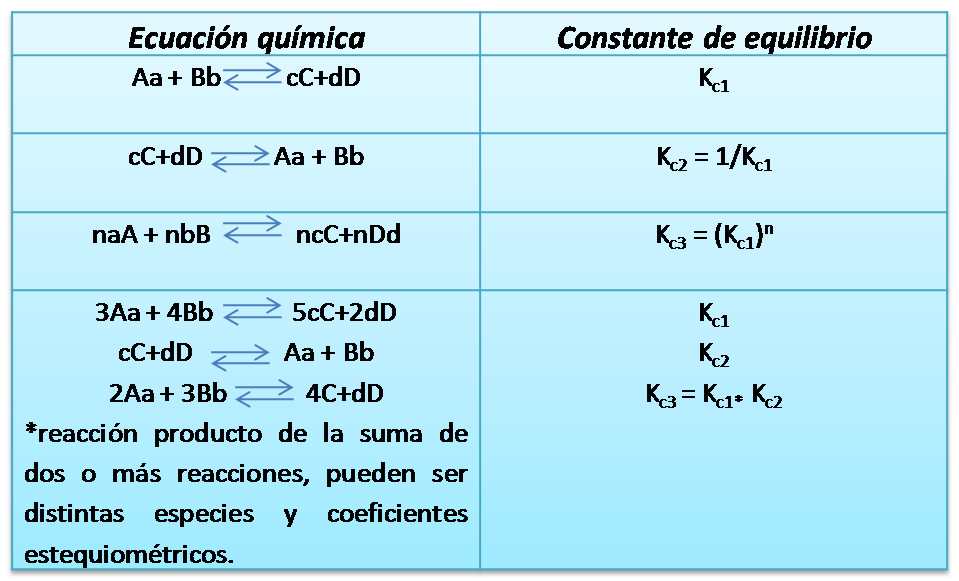
Como vemos, es muy importante en el estudio del equilibrio químico dominar la expresión de la constante de equilibrio ya que en ella se basan los cálculos de concentraciones y depende de cada reacción, por lo que si no se conocen las concentraciones en el equilibrio se pueden establecer relaciones con otras reacciones para hallar su valor.
Es importante destacar que la constante únicamente se expresa para reacciones reversibles, depende de la temperatura, y las concentraciones para determinar su valor son concentraciones en el equilibrio.
¡Espero les sea útil la información presentada, gracias por leer!
Referencias
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editoral Interamericana.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!