Determinación de la concentración de un analito por gravimetría indirecta
¡Hola estimados amigos!
Por lo que a partir de los datos del peso de la muestra y del precipitado se pueden realizar los cálculos para determinar la composición de la muestra o calcular la cantidad de analito presente. Dentro del análisis gravimétrico se encuentra la gravimetría directa e indirecta, es por ello que resulta importante el conocimiento de cómo se pueden emplear los datos de los pesos obtenidos para así calcular la concentración en cada caso.
 Fuente: @yusvelasquez
Fuente: @yusvelasquezComenzaremos en este post con el estudio de la gravimétria indirecta que resulta un poco más compleja, en donde la determinación de la concentración del analito se basa en la medición del cambio de masa de la muestra ocasionado por la pérdida del analito, por ejemplo la determinación de la cantidad de agua que contiene un alimento se puede realizar calentando la muestra hasta una temperatura en la que el agua se evapore, luego se pesa la muestra final y por diferencia se determina la cantidad de agua presente.
Por otra parte, la concentración de analito se puede determinar basados en la masa de un compuesto formado por una reacción en la que interviene el analito, por lo que esta químicamente relacionado con él, con lo que se obtiene una medición indirecta de la masa que existía en la muestra original. En estos casos donde no se puede calcular directamente la concentración del analito, se hace uso de ecuaciones para obtener su concentración.
Cálculos de gravimetría indirecta

Cuando se tienen dos sustancias puras, se aíslan, se pesan para luego de ser sometidas a una determinada acción química o por un nuevo análisis del material se obtiene información de alguno de los dos componentes, por medio del cual se determina su composición y el otro componente se determina por diferencia.
Aplicación
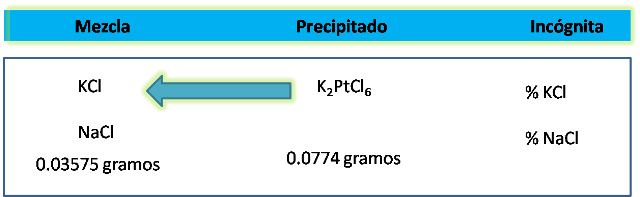
Cuando se analizó una muestra que pesaba 0.03575 gramos de KCl y NaCl se obtuvieron 0.0774 gramos de K2PtCl6.
Incógnita: Calcular el porcentaje en que se encuentran los cloruros en la muestra analizada.
El planteamiento es el siguiente:
Con la información presentada se puede escribir la siguiente ecuación:
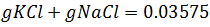
Como podemos observar en la imagen del planteamiento, el precipitado formado se puede relacionar con el factor gravimétrico con el KCl, calculando así los gramos de KCl por medio de las siguientes ecuaciones:

Una vez calculados los gramos del KCl ahora por diferencia se pueden calcular los gramos de NaCl despejando de la primera ecuación planteada:
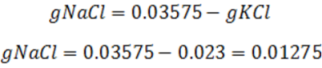
Finalmente se pueden calcular los porcentajes de los cloruros presentes en la muestra
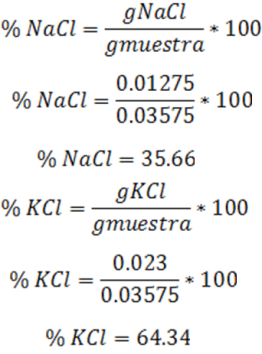
La muestra consiste entonces en 35.66% de NaCl y 64.34% de KCl

Cuando dos sustancias químicas puras se aíslan y se pesan, para luego ser convertidas en compuestos diferentes, obteniendo nuevamente los pesos combinados y que mediante el uso de sistemas de ecuaciones se establecen ecuaciones independientes para obtener las incógnitas.
Aplicación
Una muestra de 0.25g se analiza y se obtiene una mezcla de cloruros de potasio y sodio que pesa 0.059g. Un tratamiento posterior con nitrato de plata produce 0.1225g de cloruro de plata.
Incógnita: Calcular el porcentaje de K2O y Na2O en la muestra.
El planteamiento es el siguiente:
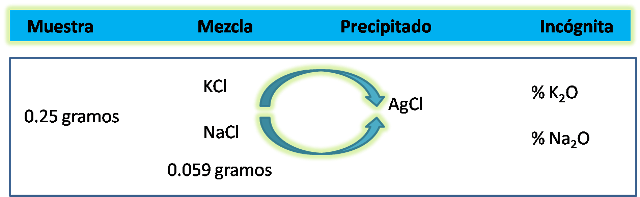
Con la información presentada se puede escribir la siguiente ecuación
Y = gramos de NaCl
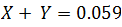
Como podemos observar en el planteamiento, el precipitado en este caso está relacionado con ambos compuestos, el KCL y el NaCl, por lo que debemos calcular cuánto AgCl se formó a partir de cada uno aplicando el factor gravimétrico.
- Cálculo de los gramos de AgCl obtenidos a partir del KCl

- Cálculo de los gramos de AgCl obtenidos a partir del NaCl

Con ambas expresiones podemos escribir la siguiente ecuación
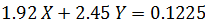
Se tiene ahora un sistema de dos ecuaciones con dos incognitas
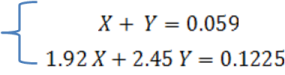
Resolviendo se tienen los siguientes resultados
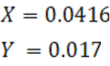
La mezcla contiene 0.0416 gramos de KCl y 0.017 gramos de NaCL. Aplicando el factor gravimétrico podemos dar respuesta a la incógnita
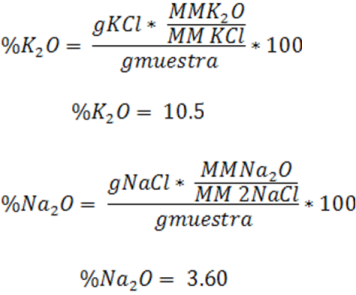
Como podemos observar resulta muy importante identificar el tipo de cálculo gravimétrico que se debe realizar para así obtener los datos necesarios y determinar la concentración del analito en la muestra.
¡Espero que la información presentada sea de gran utilidad, gracias por leer!
Referencias
- Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
- Hamilton, Simpson y Elis (1988). Cálculos de Química Analítica. Mc Graw Hill
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (80% of the curation rewards are returned).
Please consider including @stemsocial as a beneficiary to get a stronger support.
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more