Determinación de sulfatos en una muestra de agua por gravimetría de precipitación
Como sabemos, la calidad del agua es de suma importancia para nuestra sociedad, ya que de la calidad del agua de consumo depende directamente nuestra salud, y de la calidad del agua superficial depende el equilibrio de los ecosistemas. Y si bien, la presencia de algunos iones y minerales en el agua es beneficiosa para la reposición de electrolitos en el organismo y esenciales para algunos procesos celulares, en concentraciones elevadas pueden generar graves problemas. En el caso de los iones sulfato (SO42-), al igual que otros iones como los cloruros, estos pueden estar presentes en el agua en concentraciones variables, desde algunos ppm (partes por millón) o cientos, teniendo su origen de forma natural cuando el agua de lluvia atraviesa terrenos ricos en minerales o producto de la contaminación industrial. Y aunque en bajas concentraciones no suelen representar ningún problema en el agua potable, en concentraciones elevadas pueden generar trastornos gastrointestinales.
 Fuente: @yusvelasquez.
Fuente: @yusvelasquez.Por lo que su determinación es de suma importancia como un parámetro que determina la calidad del agua o indicativo de contaminación por actividades humanas. La determinación del contenido de sulfatos puede realizarse por varias vías diferentes, pero el método gravimétrico con cloruro de bario es uno de los más precisos y aplicados en los laboratorios analíticos.
¿Cómo llegan los Iones sulfatos al agua?
El sulfato puede estar presente en el agua natural en concentraciones que van de unos pocos o hasta incluso varios miles de ppm. La mayoría de los compuestos que contienen estos iones SO42- en el ambiente puede llegar de dos formas, por la oxidación de minerales o debidas por la contaminación causada por el hombre, podemos decir que su origen tiene dos causas:
- Procesos naturales. El agua durante su ciclo puede atravesar zonas rocosas superficiales o subterráneas con alta presencia de minerales con sulfatos, por ejemplo rocas de yeso. Por lo que, en su paso va disolviendo y arrastrando estos minerales, acumulándose en algún acuífero o embalse superficial. Por ello no es extraño encontrar elevadas concentraciones de sulfatos cuando se analiza el agua de pozos, lo que a veces impide su utilización como agua de consumo.
 Recorrido del agua por zonas rocosas. Fuente: Pxfuel.com, imagen de uso libre.
Recorrido del agua por zonas rocosas. Fuente: Pxfuel.com, imagen de uso libre.- Actividades antropogénicas: la otra forma de que conseguir iones sulfatos en agua está relacionada con la emisión de dióxido de azufre al ambiente proveniente de las actividades humanas, especialmente las que derivan de la combustión de combustibles fósiles. Ya que el dióxido de azufre (SO2) que llega a la atmosfera se combina con la humedad del aire y forma ácido sulfúrico (H2SO4), el cual al precipitarse a la superficie al caer la lluvia reacciona con rocas carbonatadas o silicatadas, dando lugar a la sulfatación de los carbonatos (CaSO4). El proceso lo podemos ejemplificar en las siguiente secuencia de reacciones:
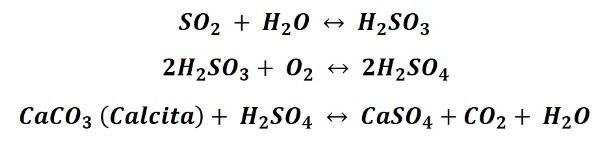
Este proceso va descomponiendo las rocas, por lo que las esculturas de yeso expuestas al ambiente sufren gran deterioro a causa de la llamada lluvia ácida.
Otra forma es mediante el vertido de aguas residuales de origen industrial en embalses superficiales. Especialmente los vertidos de las industrias mineras y metalúrgicas, estas aguas de características ácidas suelen tener una elevada concentración de sulfatos y metales. En la industria química los compuestos sulfatados son una materia prima muy común, especialmente en la industria de los fertilizantes y pesticidas, por lo que no es extraño que grandes cantidades de estos se eliminen en sus vertidos.

Vertidos de aguas industriales. Fuente: Wikimedia Commons, imagen de dominio público.
El método de análisis
Ahora que sabemos cómo llegan estos iones al agua y estamos conscientes del problema que generan veamos el método de análisis empleado para determinar su concentración en el agua.
El análisis gravimétrico se basa en la medición de la masa de una sustancia de composición conocida que esta químicamente relacionada con el analito (la especie química a determinar). Esta técnica de análisis incluye métodos de precipitación, volatilización y electrodepososición, en este post haremos referencia a la aplicación del primero en la determinación de la concentración de ion sulfato en una muestra de agua problema.

Precipitado de sulfato de bario. Fuente:@yusvelasquez.
La determinación de sulfatos en una muestra de agua es un procedimiento sencillo cuando se utiliza el método gravimétrico, mediante este, se hace precipitar el contenido de iones sulfatos como sulfatos alcalinos, que luego se pueden separar de la muestra por una filtración simple.
El método consiste en hacer reaccionar el analito presente en la muestra con cloruro de bario (BaCl2) desde una solución caliente y acidificada con ácido clorhídrico (HCl), y luego de un periodo de digestión el precipitado de sulfato de bario producto de la reacción, que se forma como un precipitado cristalino, se recoge en un filtro adecuado, se lava con agua para eliminar los iones cloruro, se seca y se pesa. A partir de la masa de sulfato de bario BaSO4, se calcula la cantidad de sulfato presente en la muestra original. La reacción de precipitación es la que sigue:
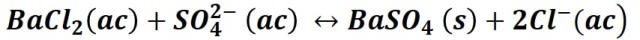
Preparación
Se debe tener presente que para la recolección y análisis de las muestras se deben seguir ciertas reglas; por ejemplo, se necesita una cantidad mínima de agua de dos litros para el análisis, los envases a utilizar deber ser preferiblemente de plástico y deben ser enjuagados previamente unas tres veces con la misma agua que se va a muestrear. Particularmente, para muestras de agua de embalses se requiere muestrear a diferentes profundidades, y a varios metros de la orilla.
Procedimiento
Se toma una muestra de 300 mL de la muestra de agua problema en un vaso de precipitado grande, luego se le adicionan unas gotas de indicador rojo de metilo y se ajustar el pH entre 4.5-5.0 adicionando algunas gotas de HCl, hasta observar el cambio de color de la solución.

Cambio de color en la solución al añadir el idicador. Fuente: @yusvelasquez.
Se toma un vaso de precipitado de 250 mL y se vierten 50 mL de la muestra, luego se lleva a calentar sobre una plancha de calentamiento hasta aproximadamente 90 °C (preferiblemente hasta notar que se empañan las paredes del vaso, si utiliza un termómetro procure enjuagar con agua la punta antes de sacarlo completamente del vaso precipitado para evitar extraer parte de la solución). Aunque se debe evitar hervir la solución, ya que es posible que se pierda parte de la solución por salpicaduras; es necesario mantener la solución a una temperatura elevada para facilitar la formación de grandes partículas filtrables y para minimizar la coprecipitación de iones extraños.

Calentamiento de la solución. Fuente: @yusvelasquez.
Se monta una bureta con solución de cloruro de bario al 5% sobre el vaso precipitado con la muestra y se agrega lentamente y con agitación la solución de BaCl2 hasta observar la precipitación completa aparente, luego se deja reposar la solución hasta observar la sedimentación del precipitado.

Titulación de la muestra con BaCl2. Fuente: @yusvelasquez.
Luego se agregan algunas gotas de cloruro de bario sin agitar, y se verifica si hay más formación de precipitado suspendido en la solución, en ese caso continuar con la adición de BaCl2. En caso contrario añadir 2 mL en exceso. Se cubre el vaso precipitado y se lleva a digerir el precipitado en la estufa entre 80-90ºC, durante 30 minutos.

Digestión de la muestra en estufa. Fuente: @yusvelasquez.
Mientras se digiere el precipitado se identifica y pesa un papel filtro Whatman #42, y se coloca este en un embudo de tallo largo. Completado el periodo de digestión, se filtra el precipitado y se lava tres veces con pequeñas porciones de agua destilada caliente hasta que los lavados estén libres de iones cloruros (Cl-).

Filtrado de la muestra. Fuente: @yusvelasquez.
Luego se coloca el papel filtro en un vidrio de reloj y se lleva a secar en estufa a 105°C durante 2 horas.

Papel filtro más el precipitado filtrado. Fuente: @yusvelasquez.
Una vez seco se pesa la muestra con el papel filtro y se resta el peso del papel para conocer el peso del precipitado.
Resultados
Conocido el peso del precipitado, se puede conocer el peso de iones sulfatos contenidos inicialmente en la muestra siguiendo la estequiometria de la reacción, como sigue:
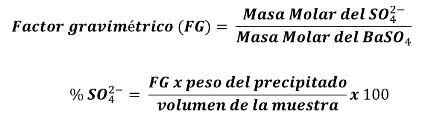
Interferencias
Hay que tener en cuenta algunos factores a la hora de realizar el método. Por ejemplo, la variación de la acidez, la temperatura, la forma de adición del precipitante y el tiempo de digestión afectan notablemente a la formación del precipitado y su posterior filtración. Por otro lado, aniones extraños como el nitrato, el clorato y el cloruro pueden coprecipitar como sus sales de bario. La coprecipitación del cloruro puede disminuirse mediante la lenta adición del precipitante, y como el nitrato y el clorato interfieren incluso en concentraciones bajas, estos deben detectarse, y de ser necesario, eliminarse de la solución antes de llevar a cabo la precipitación.
Otras interferencias son los sólidos suspendidos y la materia orgánica presente en la muestra, sobre todo cuando se analizan muestras de aguas residuales. Estas pueden ser eliminadas por filtración antes del análisis de sulfatos.
Conclusión y aporte
Los sulfatos son un motivo de gran preocupación porque son responsables de acelerar la corrosión de los metales, especialmente el de las tuberías de distribución y en plantas de tratamiento de aguas residuales, además generan malos olores en las aguas superficiales resultado de la reducción de los sulfatos a sulfuro de hidrógeno en condiciones anaeróbicas. Su afectación en las personas está relacionado con la ingestión de aguas con una alta concentración de sulfatos, teniendo un efecto laxante tras ingerir agua con más de 100 mg/L de sulfatos de sodio o magnesio, teniendo como efecto secundario la deshidratación producto de un cuadro diarreico. Por lo que su determinación es de suma importancia dentro de los análisis rutinarios al agua para establecer su calidad.
El presente artículo permite dar a conocer el método analítico para la determinación de sulfatos presentes en una muestra de agua mediante la gravimetría de precipitación, haciendo uso del cloruro de bario como agente precipitante. Siendo este un método confiable y muy preciso para la detección de sulfatos en concentraciones desde 10 ppm, y uno de los más aplicados en los laboratorios de análisis químico en la caracterización de muestras de agua problema. También sirve de referencia para los estudiantes de química analítica que necesiten consultar el procedimiento del mismo.
Bueno amigos, hasta aquí el presente post, espero que la información presentada les sea de mucha utilidad, recuerden que para obtener un resultado confiable se requiere aplicar la técnica analítica apropiada. ¡Hasta un próximo post!
Referencias
Ramírez D., Velásquez, Y., Lugo, O., Ferreira, M., Quintero, M. (2015). Guías prácticas del laboratorio de Química Analítica Universidad Nacional Experimental Francisco de Miranda.
APHA-AWWA-WEF (2005). Standard Methods for the Examination of Water and Wastewater.
¡Felicitaciones!
1. Invierte en el PROYECTO ENTROPÍA y recibe ganancias semanalmente. Entra aquí para más información.
3. Suscríbete a nuestra COMUNIDAD, apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
4. Creación de cuentas nuevas de Hive aquí.
5. Visita nuestro canal de Youtube.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias equipo de @entropia
Sin duda algunas este tipo de análisis son de suma importancia, ya que como mencionas en tu escrito el agua es vital para supervivencia de nuestro ecosistema y vital para nuestra salud. Con respecto al método que usas para poder determinar ciertas sustancias o minerales que se encuentran en el agua es bastante interesante emplear el método gravimétrico, se muy bien que es muy eficiente para este tipo de caracterización, pero que tan eficiente puede ser para determinar la concentración de sulfatos?
Saludos @carloserp-2000, gracias por el comentario. Es bastante preciso para concentraciones por encima de los 10 ppm, siempre que se controlen las posibles interferencias el método es muy efectivo y confiable, de hecho es el más utilizado en los laboratorios de análisis, ya que métodos como el volumetrico se recomiendan sólo cuando este no es posible de realizar y en los métodos ópticos el color y la turbidez del agua son un gran problema a la hora de realizar el ensayo.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Muchas gracias por el apoyo amigos!
La calidad del agua es esencial para la población sobre todo para consumo, y tal como mencionas este componente químico puede deteriorar las tuberías, es decir, acortar la vida útil del sistema de abastecimiento de agua e instalaciones de aguas blancas. Buen trabajo, saludos.
Saludos @acont, gracias por pasar a leer. Ciertamente es esencial, contar con agua de calidad es vital para la salud de la población y en el área industrial pues estos iones tienen como consecuencia la corrosión y deterioro de las linias de distribución, lo que genera mayor costo de mantenimiento.