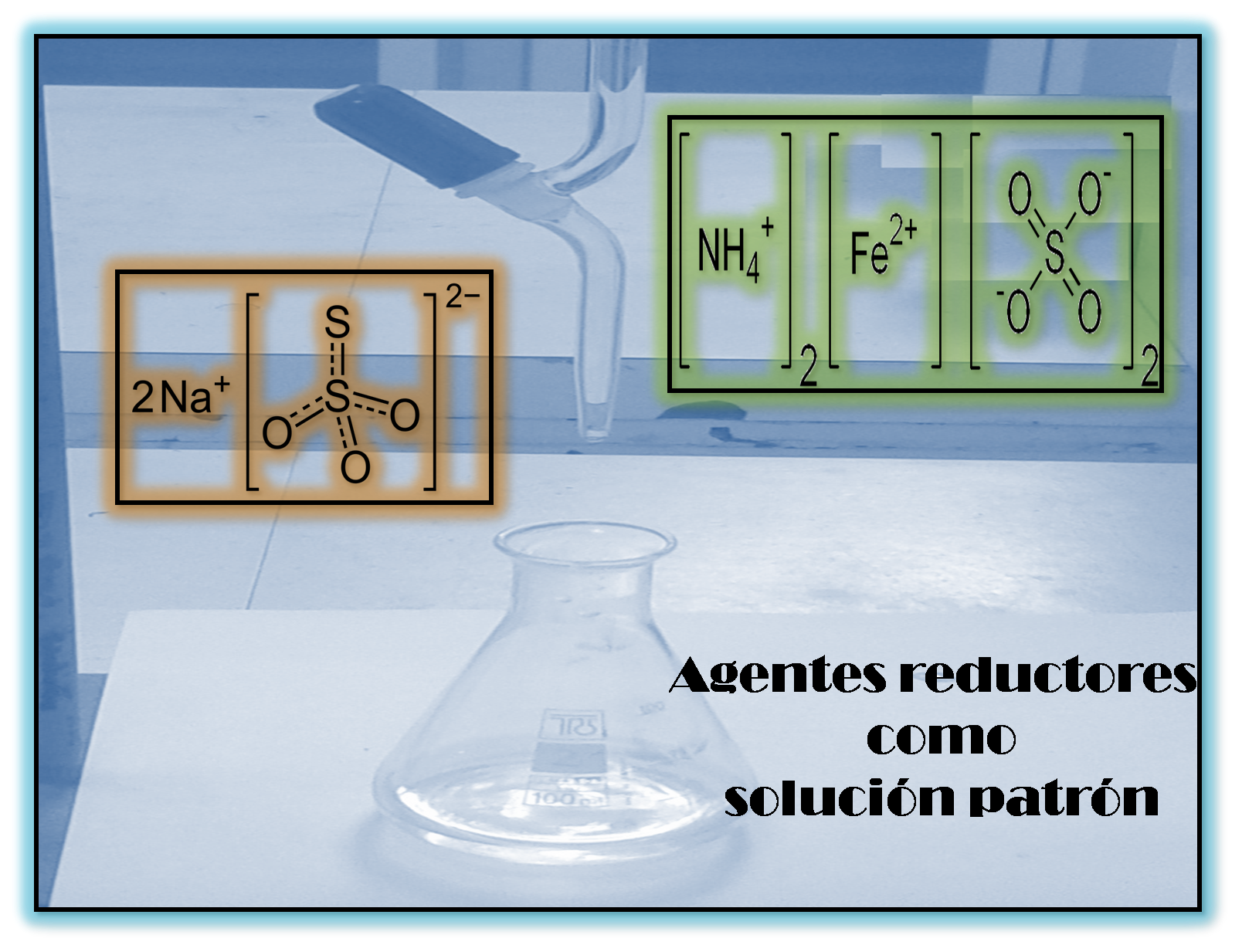
Agentes reductores empleados como solución patrón en una volumetría redox
¡Hola estimados amigos!
Fuente: @yusvelasquez
El agente oxidante se conoce como la sustancia que oxida a otra, por tanto acepta electrones y se reduce. Mientras que el agente reductor, es la que reduce a la otra sustancia por lo que pierde electrones y se oxida. Con las volumetrías redox se pueden determinar una amplia variedad de analitos de interés en distintos campos, como el ambiental, procesos industriales, tratamiento de agua entre otros; por lo que es importante conocer sobre las propiedades de las soluciones que se emplean en los análisis ya que influye en los resultados.
En los análisis volumétricos el agente valorante debe poseer una concentración conocida y permanecer estable, debe reaccionar rápida y completamente con el analito. En el caso de las soluciones patrón reductoras existe la desventaja que la mayoría no son muy estables, ya que reaccionan con el oxígeno atmosférico por lo que son muy poco empleadas en la valoración directa de especies oxidantes.
Es por ello que describiremos los más empleados, entre los que se encuentran el tiosulfato de sodio y el hierro(II).
Comencemos con el tiosulfato de sodio
Es un compuesto inorgánico cristalino que frecuentemente se encuentra en forma de pentahidrato Na2S2O3•5H2O y a partir de este compuesto se preparan las disoluciones que deben ser estandarizadas antes de ser utilizadas en el análisis.
El ion tiosulfato (S2O3-2) en su estructura presenta forma tetraédrica. Es un agente reductor de fuerza moderada y es el más utilizado en la determinación de distintos agentes oxidantes en un proceso indirecto en donde se emplea el yodo como intermediario por medio de una reacción rápida.
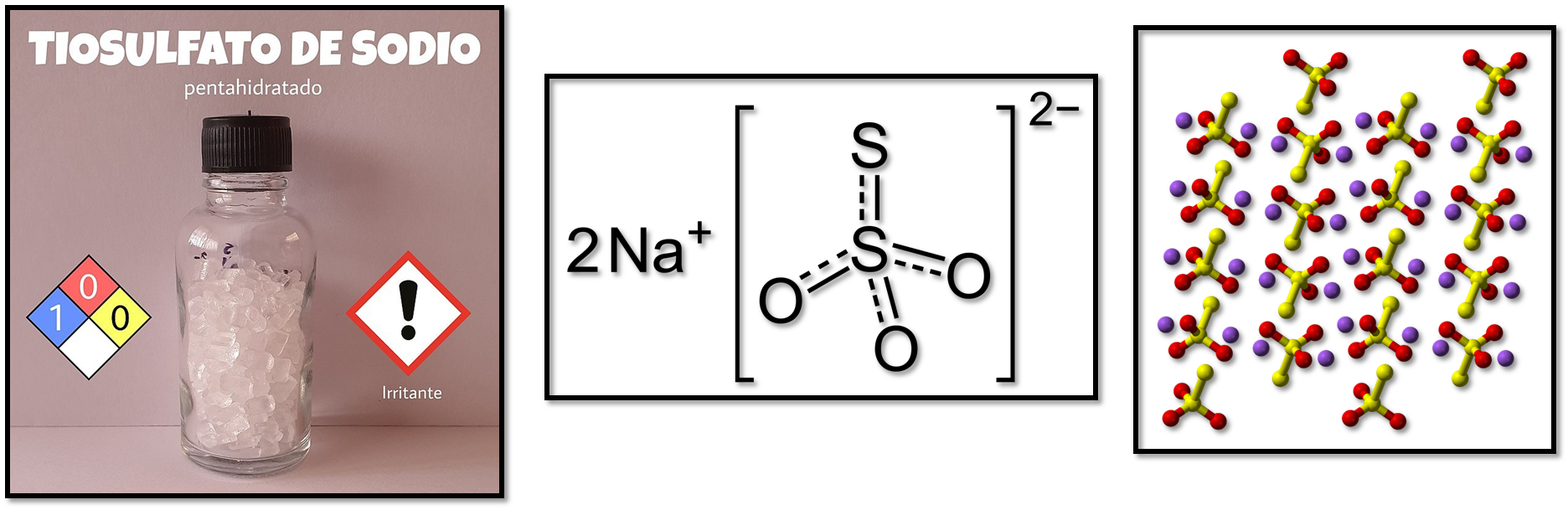
Tiosulfato de sodio. Fuente:1,2.3
El proceso empleando el yodo como intermediario consiste en adicionar un exceso de yoduro de potasio a la solución que contiene el analito. En la reacción se reduce el analito produciendo una cantidad estequiométrica equivalente de yodo. Es así como el yodo que se libera en la reacción, se titula con solución patrón de tiosulfato por la siguiente reacción:
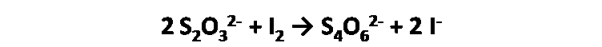
Como se observa, el yodo provoca que el ion tiosulfato se oxide cuantitativamente a ion tetrationato mediante la siguiente semireacción

Entre las características más destacadas de las soluciones de tiosulfato resalta el hecho de que constituyen uno de los pocos agentes reductores que no se oxidan por el aire, son estables, y que requerirán solo en ocasiones volver a valorarse para determinar su concentración. Sin embargo, se pueden descomponer formándose azufre e ion hidrógeno sulfito.

La descomposición es lenta y se debe a distintos factores, entre los que se pueden encontrar el pH, presencia de microorganismos, la concentración de la solución, exposición a la luz solar por lo que deben prepararse cuidadosamente.
Algunas aplicaciones
Entre las sustancias que se pueden determinar empleando el tiosulfato de sodio como solución patrón por el método indirecto se encuentran las siguientes:
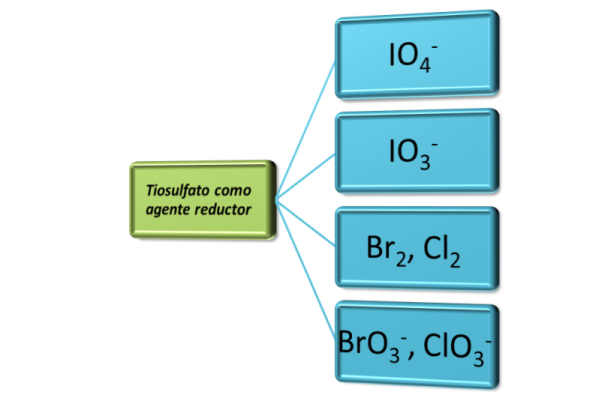
Fuente: imagen realizada en power point con datos de Skoog (2000)
Cabe destacar que en las valoraciones de tiosulfato-yodo generalmente se emplea el almidón como indicador, sin embargo hay que tomar en cuenta que este indicador se descompone irreversiblemente en soluciones con grandes concentraciones de yodo por lo que debe tomarse la precaución de adicionarlo cuando se observe el cambio de color de café-rojizo a color amarillo donde se está cerca del punto final hasta que la solución se torne incolora.

Cambio de color en una valoración tiosulfato-yodo. Fuente: wikipedia.org
Soluciones de Hierro (II)
Estas soluciones poseen la característica de ser inestables en medios neutros ya que se oxidan por el aire, sin embargo se pueden emplear en medios ácidos. Las soluciones más estables se preparan en ácido sulfúrico 0.5M y se recomienda estandarizar periódicamente.
Las soluciones patrón de hierro se preparan partiendo del sulfato de amonio y hierro (II) (sal de Mohr) o sulfato de hierro (II) y etilendiamina.

Sulfato de amonio y Hierro (II). Fuente: wikipedia.org
En la valoración con hierro (II) se adiciona un exceso conocido de esta solución para que reaccione con el analito y el exceso se titula inmediatamente con una solución patrón de Dicromato de potasio o de cerio (IV).
Entre las sustancias que se pueden determinar empleando el hierro (II) como solución patrón se encuentran las siguientes:
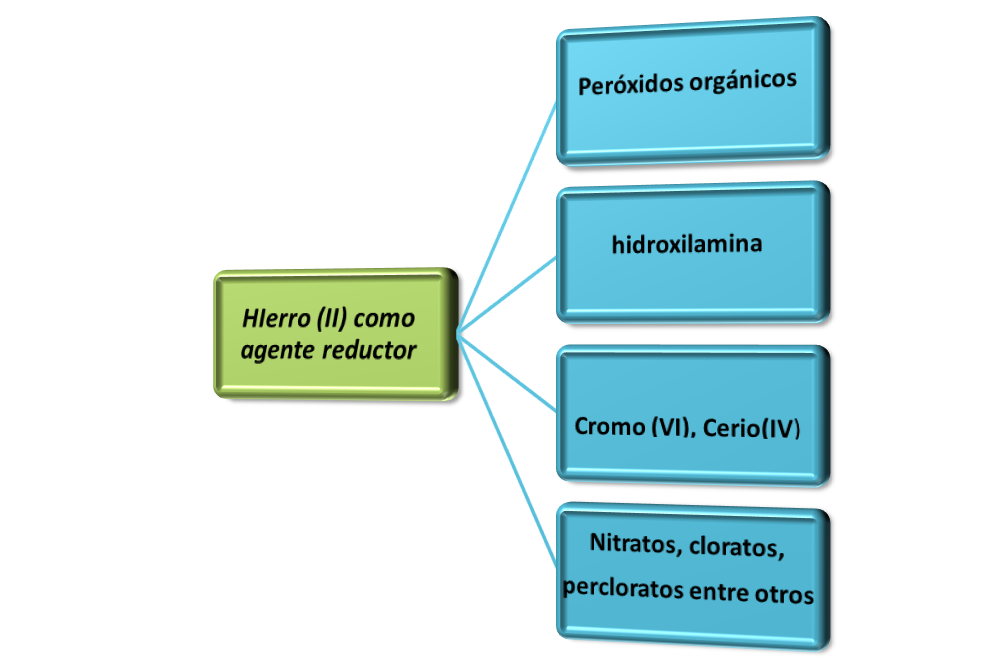
Fuente: imagen realizada en power point con datos de Skoog (2000)
Como vemos previamente al análisis es importante seleccionar los reactivos y soluciones a utilizar en base a sus propiedades y al analito que se va a determinar cuantitativamente ya que especialmente la solución patrón juegan un papel importante en las volumetrías por lo que deben conocerse la variedad que existen y sus campos de aplicación.
Hasta aquí la información, gracias por leer
Referencias
- Tiosulfato de sodio
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
- Volumetrías de oxidación- reducción
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
es una sal relativamente barata y se puede utilizar muy bien para indicar la presencia de metales en alguna solucion