Fundamentos de Bioquímica: propiedades físicas de los compuestos orgánicos [ES] ⊛ Fundamentals of Biochemistry: physical properties of organic compounds [EN]
Este informe ofrece una sencilla pero factible orientación para el aprendizaje autónomo en relación a las fuerzas de Van der Waals; así mismo, se les recomienda justificar el proceso de aprendizaje apoyados en otras lecturas y visitas a los diferentes sitios de internet o prácticas de laboratorio para que puedan continuar comprendiendo el conocimiento aquí expuesto.
This report offers a simple but feasible orientation for autonomous learning in relation to Van der Waals forces; likewise, it is recommended to justify the learning process supported by other readings and visits to different internet sites or laboratory practices so that they can continue to understand the knowledge presented here.

Calculated structure of an icosahedral water cluster (H2O)100
Fuerzas intermoleculares o Fuerzas de Van der Waals
Los compuestos orgánicos poseen ciertas propiedades físicas que determinan sus características. Existe una relación de estas propiedades con respecto a sus estructuras moleculares; ésta relación dada, en primer término, son las llamadas fuerzas intermoleculares o fuerzas de Van der Waals.
Intermolecular Forces or Van der Waals Forces
Organic compounds possess certain physical properties that determine their characteristics. There is a relationship of these properties with respect to their molecular structures; these relationships given, in the first instance, are the so-called intermolecular forces or Van der Waals forces.
“…son las fuerzas atractivas o repulsivas entre moléculas distintas a aquellas debidas a un enlace intermolecular (enlace iónico, enlace metálico y enlace covalente de tipo reticular) o a la interacción electrostática de iones con moléculas neutras…” ✱Fuerzas de Van der Waals
“…are the attractive or repulsive forces between molecules other than those due to intermolecular bonding (ionic bonding, metallic bonding and covalent reticular bonding) or to the electrostatic interaction of ions with neutral molecules…” ✱Van der Waals forces
En las moléculas de carácter polar, la zona positiva de una molécula atrae a la negativa de la otra, por lo que debe sorprendernos el hecho de que las sustancias polares se aportan tanto de su comportamiento como del modo de ser del gas ideal. Un caso notable es el vapor de agua no tan idealmente se comporta este gas que, incluso a la temperatura ambiente, basta una ligera presión para licuarlo. El físico holandés Van der Waals, fue quién sugirió las existencia de las fuerzas intermoleculares entre moléculas no polares y en su honor reciben su nombre, tienen su origen en los movimientos de los átomos y moléculas, estas fuerzas siempre están presentes allí donde existe materia.
In molecules of polar character, the positive zone of one molecule attracts the negative zone of the other, so we should be surprised by the fact that polar substances contribute as much to their behavior as to the mode of being of the ideal gas. A notable case is water vapor, which behaves not so ideally that, even at room temperature, a slight pressure is enough to liquefy it. The Dutch physicist Van der Waals, who suggested the existence of intermolecular forces between non-polar molecules and in his honor they receive their name, have their origin in the movements of atoms and molecules, these forces are always present wherever there is matter.
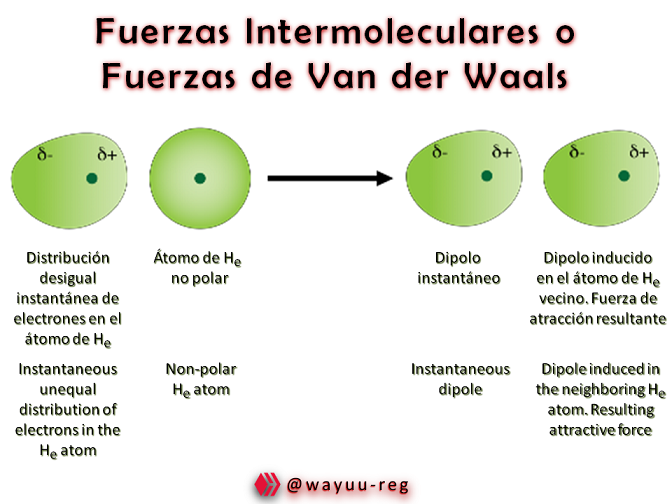
Las fuerzas de Van der Waals se explican de la siguiente manera:
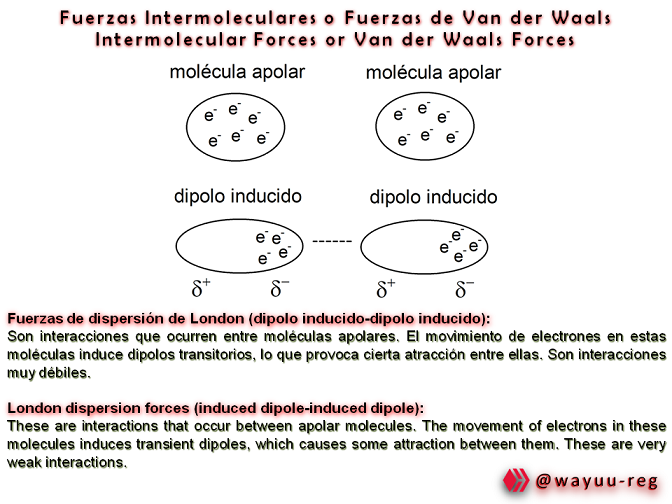
Supongamos dos átomos de neón muy próximos, y supongamos también que la distribución electrónica del primer átomo I, se hace por un instante asimétrica, con ligera preponderancia de cada clase de carga en cada uno de los lados. Durante una fracción de microsegundo, el átomo adquiere tal estado que una zona aparece débilmente negativa y otra ligeramente positiva, esto es, se convierte por un momento en un dipolo. En tal caso, el átomo cercano resulta deformado, ya que la región positiva del I atrae a los electrones del II, obligándolos a desplazarse. Como muestra la figura, cada uno de los átomos se ha convertido transitoriamente en dipolo, produciéndose la consiguiente atracción. La situación solo dura un tiempo brevísimo, debido al movimiento de los electrones en el seno de los átomos. Los del átomo I se desplazan rápidamente al lado opuesto, movimiento al que sigue el de los electrones del átomo II. Cabe imaginar que las fuerzas de Van der Waals se producen como resultado de batir u oscilar periódico de los electrones en las moléculas próximas, dando lugar a una configuración de dipolos fluctuantes, los cuales, al mismo tiempo, van creando atracciones instantáneas que duran tan sólo un momento. Estas atracciones son fuertes cuando las moléculas se acercan mucho, pero se debilitan rápidamente cuando se separan. Como es lógico, estas fuerzas también son más intensas cuando más electrones contienen las moléculas y cuando más débiles con las ligaduras que los unen.
Van der Waals forces are explained in the following way:
Suppose two atoms of neon very close to each other , and suppose also that the electronic distribution of the first atom I, becomes for an instant asymmetric, with slight preponderance of each kind of charge on each of the sides. For a fraction of a microsecond, the atom acquires such a state that one zone appears weakly negative and another slightly positive, that is, it becomes for a moment a dipole. In such a case, the nearby atom is deformed, since the positive region of I attracts the electrons of II, forcing them to move. As the figure shows, each of the atoms has transiently become a dipole, producing the resulting attraction. The situation only lasts a very short time, due to the movement of the electrons within the atoms. Those of atom I move rapidly to the opposite side, followed by the movement of the electrons of atom II. It can be imagined that Van der Waals forces are produced as a result of periodic churning or oscillating of electrons in nearby molecules, giving rise to a configuration of fluctuating dipoles, which, at the same time, create instantaneous attractions that last only a moment. These attractions are strong when the molecules come very close together, but weaken rapidly when they are separated. Not surprisingly, these forces are also stronger the more electrons the molecules contain and the weaker the bonds that bind them.
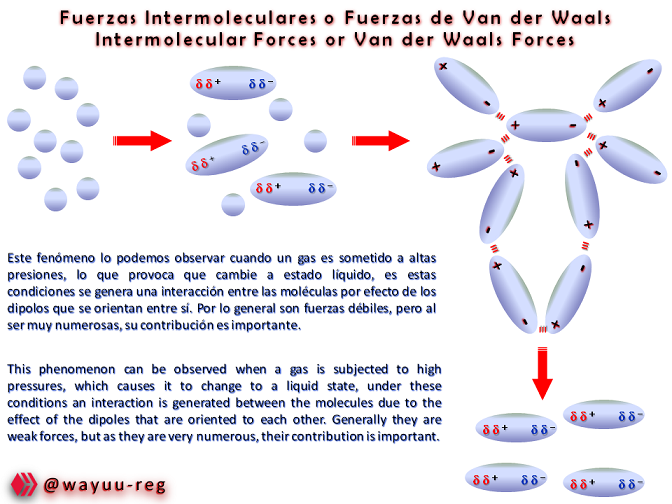
Estas fuerzas hacen que se forme un enlace no covalente permitiendo la estabilización molecular, en donde intervienen dos fuerzas: una denominada de Dispersión y otra repulsiva, llamada Repulsión Electrostática, con lo cual se forma la unión intermolecular: mediante la formación de Dipolos que hacen fusionar las moléculas polares.
These forces cause the formation of a non-covalent bond allowing molecular stabilization, where two forces intervene: one called Dispersion and the other repulsive, called Electrostatic Repulsion, with which the intermolecular union is formed: through the formation of Dipoles that make polar molecules fuse.

Information from the article: Van der Waals Forces
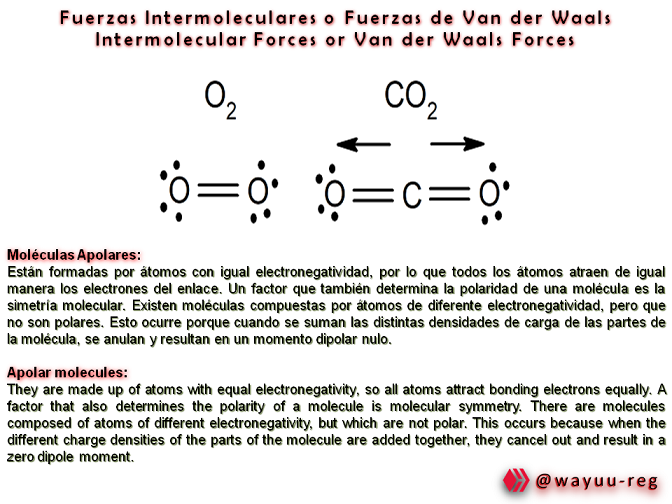
Information from the article: Van der Waals Forces

Information from the article: Van der Waals Forces
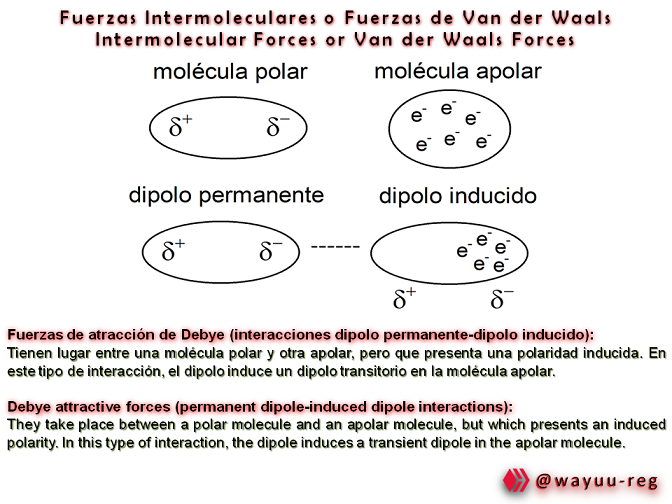
Information from the article: Van der Waals Forces
Information from the article: Van der Waals Forces
Aunque estas fuerzas sean muy débiles (en paridad con enlaces químicos normales) mantienen su importancia en la explicación de varios fenómenos químicos, ya que son responsables de ellos, como: la tensión superficial, la viscosidad, la difusión, la adhesión, la fusión de un compuesto y el aumento del punto de ebullición. Gracias a estas fuerzas diversos compuestos químicos son definidos, además son primordiales para varios campos de la biología, física y la ingeniería. Se desarrollan con la extensión del extremo no polar de la materia (sustancia), causadas por una adecuación entre polarizaciones fluctuantes que ocurren entre: superficies cercanas, átomos o moléculas, como resultado de la dinámica cuántica.
Although these forces are very weak (in parity with normal chemical bonds) they maintain their importance in the explanation of several chemical phenomena, since they are responsible for them, such as: surface tension, viscosity, diffusion, adhesion, fusion of a compound and the increase of the boiling point. Thanks to these forces, various chemical compounds are defined, and they are essential for various fields of biology, physics and engineering. They develop with the extension of the non-polar end of matter (substance), caused by a matching between fluctuating polarizations occurring between: close surfaces, atoms or molecules, as a result of quantum dynamics.

Otra de sus características es que presenta Anisotropía, ya que, dependiendo de la orientación de sus moléculas, sus propiedades cambian, a menudo precisa que sean de repulsión o de atracción. Son, además, decisivas para la creación de proteínas.
Another of its characteristics is that it presents Anisotropy, since, depending on the orientation of its molecules, its properties change, often requiring repulsion or attraction. They are also decisive for the creation of proteins.
¡ Muchísimas gracias por su amable atención !
Y recuerde que donar sangre,
es salvar muchas vidas
es salvar muchas vidas
Thank you very much for your kind attention !
And remember that to donate blood,
is to save many lives
is to save many lives

Fuentes Bibliográficas (Bibliographic Sources)
✱Fuerzas de Van der Waals (Van der Waals Forces)
✱ Fuerzas de Van der Waals (Van der Waals Forces)
✱ Tipos de enlaces en las fuerzas de Van der Waals
(Types of bonds in Van der Waals forces)
✱ Todas las imágenes de esta publicación fueron editadas con la aplicación Paint y PowerPoint como imagen PNG
✱ La imagen GIF, con fotografías personales, fue editada con la aplicación en línea Picasion.com
✱ Se utilizó el logo de Hive.blog (CC0)
✱ También, se usaron en la portada el logo de Stemsocial y Ecency.com
✱ La traducción fue realizada por DeepL
Me complacería mucho recibir su valioso comentario y constructivas sugerencias sobre el tema presentado, ya que serán consideradas para la mejoría de las futuras publicaciones
✱ All images in this publication were edited with the Paint and PowerPoint application as a PNG image
✱ The GIF image, with personal photos, was edited with the online application Picasion.com
✱ The Hive.blog logo (CC0) was used
✱ Also, the Stemsocial and Ecency.com logos were used on the cover.
✱ The translation was made by DeepL
I would be very pleased to receive your valuable comments and constructive suggestions on the presented topic, as they will be considered for the improvement of future publications.

@tipu curate
Upvoted 👌 (Mana: 14/44) Liquid rewards.
I had never heard of the Van der Waals force before. It seems that it is not so strong, but according to your conclusions, as there is a large set of them it becomes important in the execution of the increase of the boiling point, among other chemical situations that this can do. I also note that it is related to surface tension, of it I performed an experiment of which I will make a publication when I have time.
Greetings @wayuu-reg
Nunca habia oido hablar antes de la fuerza Van der Waals. Tal parece que no es tan fuerte, pero según tus conclusiones, al haber un gran conjunto de ellas se hace importante en la ejecución de el aumento del punto de ebullición, entre otras situaciones químicas que esto puede hacer. También observo que se relaciona con la tensión superficial, de ella realice un experimento del cual voy hacer una publicación cuando tenga tiempo.
Saludos @wayuu-reg
https://twitter.com/1532349424168738818/status/1584526824759230465
The rewards earned on this comment will go directly to the people( @academician ) sharing the post on Twitter as long as they are registered with @poshtoken. Sign up at https://hiveposh.com.
Very important fundament to understand the chemistry of life

!1UP
You have received a 1UP from @gwajnberg!
@stem-curator
And they will bring !PIZZA 🍕.
Learn more about our delegation service to earn daily rewards. Join the Cartel on Discord.
Interesante contenido que has expuesto en este artículo. Nunca me había imaginado que esos lagartos Gecko se "pegan" sobre las superficies por esas fuerzas de Van der Waals. Podrán ser muy débiles para estos científicos, pero en realidad para mí son en verdad fuertes hasta para sostener un elemento sobre el agua sin hundirse (como un clip por ejemplo).
Saludos @wayuu-reg Te amo!
Interesting content that you have exposed in this article. I had never imagined that these Gecko lizards "stick" to surfaces because of these Van der Waals forces. They might be very weak for these scientists, but actually for me they are indeed strong even to hold an item on water without sinking (like a paper clip for example).
Regards @wayuu-reg I love you!
Buen post amiga, mi matéria favorita fue bioquimica. Creo que vi polaridad del agua y es interesante porque podemos ligar muchos compuestos con los H positivos y las O negativas por eso el agua tiene atracción muchas cosas bueh algo asi xD ya fue hace mas de 10 años
Dear @wayuu-reg,
May I ask you to review and support the new proposal (https://peakd.com/me/proposals/240) so I can continue to improve and maintain this service?
You can support the new proposal (#240) on Peakd, Ecency, Hive.blog or using HiveSigner.
Thank you!