p53 tumori sporadici ed ereditari - p53 sporadic and hereditary tumors
Introduction
In the last article an introduction about p53 and its role as guardian of the genome has been made, in this article some key concepts will be taken in hand and an overview will be given in order to further clarify the role of the oncosuppressor p53 in the development of neoplasms.
p53 sporadic and hereditary tumors
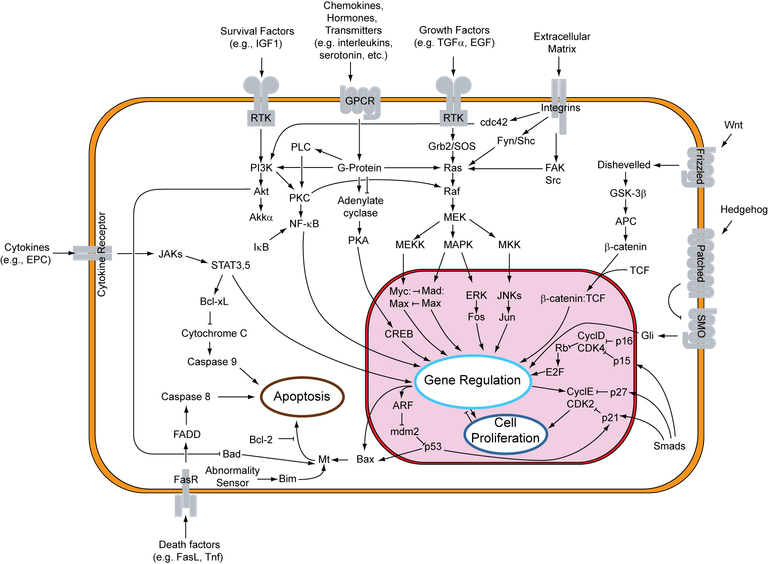
p53 is a oncosuppressant, i.e., it belongs to that category of genes whose function is to control and possibly inhibit cell proliferation. In particular, the p53 protein plays a pivotal role in the control of the cell cycle, so much so that it is also called "guardian of the genome"; this is because it is activated as a result of numerous signals coming from the cell (including DNA damage, damage from hyperactivity of oncogenes or hypoxia) and, being a transcriptional factor, it activates a packet of genes to stem this damage as much as possible.
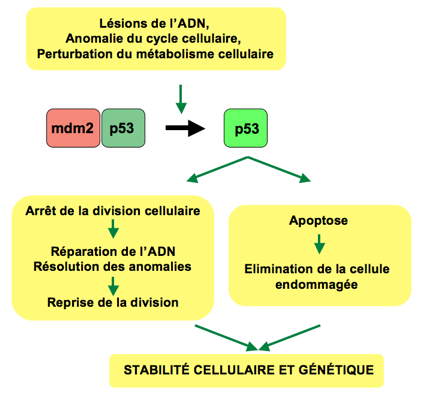
The p53 protein is physiologically present in the cell, but if not needed, it is quickly eliminated. The elimination of p53 is facilitated by a protein, MDM2, which by binding p53 allows its ubiquitination and elimination. If, on the other hand, there is damage to the DNA, specific kinases intervene, including ATM, which phosphorylate p53 and prevent its degradation.
At this point p53, being a transcriptional factor, is able to activate a series of genes necessary to repair the damage to the genome, or, if this damage cannot be repaired, it activates genes that allow apoptosis.
First, p53 activates the expression of genes that block the cell cycle, including p21 (cycline/CDK complex inhibitor) so as to prevent the damage from being transmitted to daughter cells following replication. In addition, it also activates packets of genes coding for proteins involved in the DNA damage repair mechanism.
Once the cell has repaired the damage, p53 becomes inactive and the cell can proliferate. If, on the other hand, the damage is not repairable, p53 promotes cellular senescence rather than apoptosis. The apoptosis induced by p53 affects the intrinsic pathway which is based on the release of the cytochrome C resulting in the activation of the caspase 9 and the executing caspases, which degrade DNA and cytoskeleton. This process is facilitated by the presence of proapoptotic proteins including BAX and BAK which initiate the process leading to the caspase cascade. In contrast, there are also antiapoptotic proteins, among which bcl-2 is very important; p53's task is to control the mechanism of apoptosis by favouring the expression of proapoptotic genes, to the detriment of antiapoptotics.
Finally, p53 also performs antiangiogenetic functions by favouring the expression of thrombospondin, an inhibitor of neovascularization phenomena.
p53 oncological field
In oncology this gene plays a very important role, in fact, a mutation of this gene is at the basis of many tumors. If p53 turns out to have mutated for example in the DNA binding site, it is no longer able to perform its function and the cell will have the possibility to proliferate by accumulating mutations that may be favourable to tumor growth. In order to achieve this, a direct mutation of the p53 gene is not necessary, in fact, the tumor cell may also present a hyperactivating mutation at MDM2 level, so as to go to inhibit p53. In any case, since p53 is an oncosuppressant, the mutations affecting its gene are recessive, so a double mutational stroke with loss of heterozygosity is necessary for the manifestation of the phenotype.
An example of a pathology caused by p53 mutation is the Li-Fraumeni syndrome, a very rare syndrome characterized by a very high incidence of different tumors in a large number of family members. Going to analyze the family tree of the families affected by this syndrome, we can see the presence of different tumors appearing early in patients, emphasizing the familiarity that underlies the syndrome in question.
P53 also appears to be the most frequently mutated oncosuppressant in human tumors on a somatic basis. In fact, when analyzing the genome of several tumor cells, it has been seen that a mutation at the level of this protein is one of the mutations called drivers of most tumors, including pancreatic tumors, colon tumors (both sporadic and hereditary) and endometrial tumors.
Finally, p53 mutations are also involved in tumors caused by exciting radiation from UVB radiation. These are, in fact, the cause of possible DNA damage due to the formation of pyrimidine dimers, which cause double helix distortion. The gene encoding for p53 is particularly rich in thymine dimers, therefore mutations can occur in this portion of the genome that will cause the accumulation of further mutations due to the malfunctioning of p53.
Sources
Pictures
Introduzione
Nello scorso articolo è stata fatta un'introduzione su p53 e il suo ruolo come guardiano del genoma, in questo articolo verranno ripresi in mano alcuni concetti chiave e verrà affrontata una panoramica per poter chiarire ulteriormente il ruolo dell'oncosoppressore p53 nello svilupppo di neoplasie
p53 tumori sporadici ed ereditari
p53 risulta essere un oncosoppressore, ovvero, fa parte di quella categoria di geni la cui funzione è quella di controllare ed eventualmente inibire la proliferazione cellulare. In particolare, la proteina p53 svolge un ruolo cardine nel controllo del ciclo cellulare, tanto da essere chiamata anche “guardiano del genoma”; questo perché viene attivata in seguito a numerosi segnali provenienti dalla cellula (fra cui danni al DNA, danni da iperattività di oncogeni o ipossia) ed, essendo un fattore trascrizionale, attiva un pacchetto di geni atti ad arginare il più possibile questi danni.

La proteina p53 è fisiologicamente presente nella cellula, ma, se non serve, viene rapidamente eliminata. L’eliminazione di p53 è favorita da una proteina, MDM2, la quale legando p53 ne permette l’ubiquitinazione e l’eliminazione. Nel caso in cui, invece, vi siano danni al DNA intervengono chinasi specifiche, fra cui ATM, le quali vanno a fosforilare p53 impedendone la degradazione.
A questo punto p53, essendo un fattore trascrizionale, è in grado di attivare una serie di geni necessari per la riparazione del danno al genoma, o, nel caso in cui questo danno non sia riparabile, va ad attivare geni che permettono l’apoptosi.
Innanzitutto, p53 va ad attivare l’espressione di geni che bloccano il ciclo cellulare, fra cui p21 (inibitore dei complessi ciclina/CDK) in modo tale da impedire che il danno venga trasmesso alle cellule figlie in seguito alla replicazione. Inoltre, attiva anche pacchetti di geni che codificano per proteine coinvolte nel meccanismo di riparo del danno al DNA.
Una volta che la cellula ha riparato il danno, p53 si inattiva e la cellula può proliferare. Nel caso in cui, invece, il danno non è riparabile, p53 favorisce la senescenza cellulare piuttosto che l’apoptosi della stessa. L’apoptosi indotta da p53 interessa la via intrinseca che si basa sul rilascio del citocromo C con conseguente attivazione della caspasi 9 e delle caspasi esecutrici, le quali vanno a degradare DNA e citoscheletro. Questo processo è favorito dalla presenza di proteine proapoptotiche fra cui BAX e BAK che danno inizio al processo che porta alla cascata della caspasi. In contrapposizione vi sono anche proteine antiapoptotiche, fra le quali molto importante è bcl-2; il compito di p53 è proprio quello di controllare il meccanismo di apoptosi favorendo l’espressione dei geni proapoptotici, a discapito degli antiapoptotici.
Infine, p53 svolge anche funzioni antiangiogenetiche favorendo l’espressione della trombospondina, inibitore dei fenomeni di neovascolarizzazione.

p53 ambito oncologico
In ambito oncologico questo gene svolge un ruolo molto importante, infatti, una sua mutazione è alla base di numerosi tumori. Se p53 risulta essere mutata per esempio nel sito di legame al DNA, non è più in grado di svolgere la sua funzione e la cellula avrà la possibilità di proliferare accumulando mutazioni che possono essere favorevoli alla crescita tumorale. Al fine di ottenere questo scopo non è necessaria una mutazione diretta del gene di p53, infatti, la cellula tumorale può presentare anche una mutazione iperattivante a livello di MDM2, così da andare ad inibire p53. In ogni caso, essendo p53 un oncosoppressore, le mutazioni che colpiscono il suo gene sono di tipo recessivo, perciò è necessario un doppio colpo mutazionale con perdita di eterozigosi per la manifestazione del fenotipo.
Un esempio di patologia provocata dalla mutazione di p53 è data dalla sindrome di Li-Fraumeni, sindrome molto rara caratterizzata da un elevatissima incidenza di tumori diversi in un gran numero di membri di una famiglia. Andando ad analizzare l’albero genealogico delle famiglie affette da questa sindrome, si nota la presenza di tumori diversi che compaiono precocemente nei pazienti, andando a sottolineare la familiarità che sta alla base della sindrome in questione.
P53 risulta, inoltre, essere l’oncosoppressore più frequentemente mutato nei tumori umani su base somatica. Andando ad analizzare il genoma di diverse cellule tumorali, infatti, si è visto che una mutazione a livello di questa proteina fa parte delle mutazioni chiamate driver della maggior parte dei tumori, fra cui tumori pancreatici, tumori al colon (sia sporadici che ereditari) e tumori endometriali.
Infine, mutazioni di p53 sono coinvolte anche nei tumori causati dalle radiazioni eccitanti da raggi UVB. Questi sono, infatti, causa di possibile formazione di danni al DNA dovuti alla formazione di dimeri di pirimidina, i quali causano distorsione della doppia elica. Il gene che codifica per p53 risulta essere particolarmente ricco di dimeri di timina, perciò possono instaurasi mutazioni in questa porzione di genoma che causeranno l’accumulo di ulteriori mutazioni dovute al malfunzionamento di p53.

Fonti
Immagini
!discovery 35
This post was shared and voted inside the discord by the curators team of discovery-it
Join our community! hive-193212
Discovery-it is also a Witness, vote for us here
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @steemstem account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.