p53 the guardian of the genome - p53 il guardiano del genoma
Introduction
p53 is the most frequently mutated oncosuppressant in humans and a mutation of it is associated with different types of cancer, since it encodes for a protein essential for neoplastic growth.
p53 the guardian of the genome
The importance of this gene in oncology was demonstrated by a genetic engineering experiment on mice.
Wild type mice (p53 +/+) were taken, with therefore both alleles of the p53 gene healthy, and it was seen how these survived peacefully.
In some, however, inactivating mutations of p53 to a single allele (p53 +/-) were induced, thus making them heterozygous for that mutation, and it was observed that these mice lived quietly until old age when, however, deadly tumors began to arise in some of them.
The situation became dramatic in the case of mice with both alleles of p53 mutated (p53 -/-), these in fact died prematurely, and all of them from cancer.
As far as the structure of the p53 protein is concerned, various structural domains are recognized within the protein, and in particular there is a region, which allows the binding of this protein with DNA, which is the most frequently mutated when looking for mutations of p53 in human tumors. A mutation at the level of this domain involves a loss of functionality of the protein because, being a transcriptional factor, if mutated it loses its transcriptional activity because it is no longer able to recognize the sequences within the DNA chain to which it could bind, with consequent functional loss.
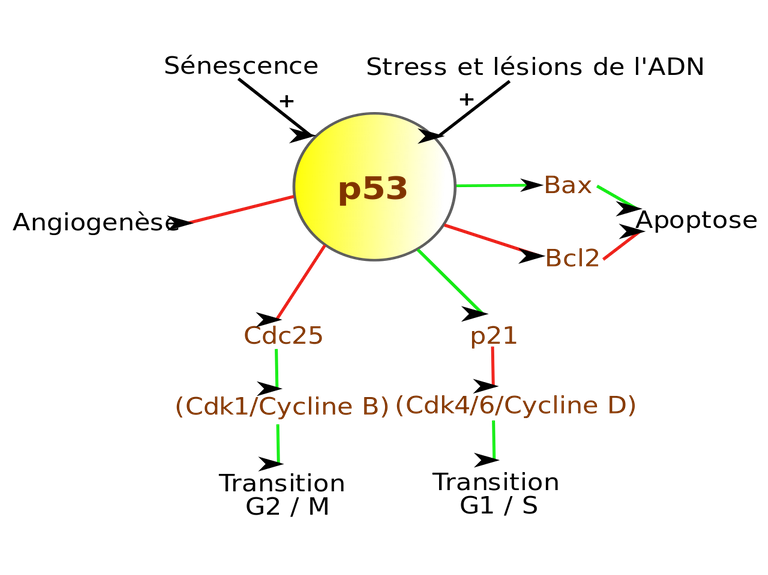
P53 is also called the guardian of the genome, to underline the fundamental role it has in controlling the cell's state of health. P53 can in fact be activated as a result of numerous signals coming from the cell (DNA damage, cellular damage resulting from hyperactivity of oncogenes, or hypoxia, or other non-physiological situations, etc.) and like all transcriptional factors plays an important role, since it controls a packet of genes coding for proteins that are very important for cell control.
Once activated, p53 in a healthy cell is able to perform several tasks.
For example, in the case of repairable DNA damage, which does not have to be duplicated to prevent the damage from being transmitted to daughter cells, p53 can:
activate the expression of genes that block cell proliferation, e.g. p21 (cycline/CDK complex inhibitor);
activate genes that are involved in the repair mechanisms of DNA damage (e.g. DNA polymerase K).
Once the cell has repaired the DNA, p53 becomes inactive and the cell may proliferate.
In the case of non-repairable damage, p53 may:
- induce apoptosis by activating the responsible genes and thus inducing the suicide of a cell with irreparably damaged DNA;
- induce senescence, so that this cell can no longer replicate.
In particular, as far as apoptosis is concerned, there are two distinct programs that activate it: the intrinsic way and the extrinsic way.
The extrinsic pathway is activated by FAS/FAS-ligand but as far as p53 is concerned, the pathway that is concerned is the intrinsic pathway, which is based on the release of cytochrome C by the mitochondrion that activates the caspase pathway, starting from caspase 9, which in turn determines the activation of other executive caspases of the apoptotic process.
The release of cytochrome C from the mitochondrion is in turn regulated by a series of proteins that have pro-apoptotic or anti-apoptotic activity.
Pro-apoptotic proteins: these are the proteins that promote the release of cytochrome C from the mitochondrion, such as Bax and Bak, initiating the processes that will lead to the cascade of caspases that will induce cell apoptosis.
Anti-apoptotic proteins: proteins that inhibit cytochrome C output, such as Bcl-2
P53 therefore controls the mechanism of apoptosis by promoting the expression of pro-apoptotic genes that induce an increase in pro-apoptotic proteins.
However, tumors can adopt different strategies to avoid apoptosis, in addition to the p53 mutation. In fact, there are other mechanisms, such as the increase in the expression of anti-apoptotic proteins, such as Bcl-2 (an example of this is follicular lymphoma in B lymphocytes, where, due to a chromosomal translocation, the gene encoding for Bcl2 is located on the long arm of chromosome 14, under the control of the regulatory sequences for immunoglobulins).
In reality, an over-expression of the Bcl-2 gene may lead to a non-suicidal cell, but this is not sufficient for the development of a tumor. This will therefore be only one of the mutations that, when added together, will allow the neoplastic transformation. If, for example, in addition to the mutation of Bcl-2 there is also a mutation at the level of an oncogene, the probability of tumor onset will increase considerably.
P53 also plays a role in the production of antiangiogenic proteins. It controls angiogenesis by inducing the expression of an extracellular matrix protein, thrombospondin, which is a powerful inhibitor of neovascularization phenomena.
As far as the regulation of P53 is concerned, it is always produced by the cell and then degraded. If it is not needed, it is quickly eliminated: it is bound by a protein, the Mdm2 protein, which by binding P53 allows its ubiquitination and degradation in the proteosome.
In a healthy cell, therefore, p53 levels will be extremely low.
In the event of DNA damage, or other types of damage, the situation in the cell changes, because there is an activation of proteins, which in turn activate kinases responsible for the phosphorylation of p53, which once phosphorylated is no longer attacked by the Mdm2 protein, and therefore is no longer degraded but, on the contrary, accumulated and then transferred to the nucleus where it will play its role as guardian of the genome.
So if p53 has changed and is not able to bind the DNA, the cell no longer stops, does not repair the damage, does not commit suicide and does not go into senescence, all perfect conditions for a cancer cell.
Also in this case it is not necessarily necessary to change p53, but, as for Rb, there are alternative strategies that a cancer cell can undertake, such as inactivating MDM2, the important thing is to inactivate p53, regardless of whether it happens directly or indirectly.
The inactivation of p53 also becomes unfortunately fundamental when a tumor is treated therapeutically to eliminate it, through radiotherapy or chemotherapy.
This is because both radiotherapy and chemotherapy tend to kill cancer cells causing damage in them that induce apoptosis of the cell itself, but if a cell has mutated p53, it is not necessarily suicidal, so in tumors with mutated p53 there is a real possibility that they are much more resistant to radiotherapy and chemotherapy.
For this reason, the laboratory tests that are carried out on cancer patients can often include the analysis of the state of p53, in order to observe the possible mutation and decide the most appropriate treatment.
An example of a pathology caused by p53 mutation is the Li-Fraumani syndrome, a very rare syndrome characterized by a very high incidence of different tumors in a large number of family members, often at a young age. This pathology is linked to a genetic problem closely associated with cancer associated with the mutation of the gene coding for the p53 protein.
Introduzione
p53 rappresenta l’oncosoppressore più frequentemente mutato negli esseri umani ed una sua mutazione è associata a diversi tipi di tumore, dal momento che codifica per una proteina essenziale per la crescita neoplastica.
p53 il guardiano del genoma

L’importanza di tale gene in ambito oncologico è stata dimostrata tramite un esperimento di ingegneria genetica svolto su dei topini.
Sono stati presi topini wild type (p53 +/+), con quindi entrambi gli alleli del gene p53 sani, e si è visto come questi sopravvivevano tranquillamente.
In alcuni invece sono state indotte mutazioni inattivanti di p53 ad un solo allele (p53 +/-), rendendoli dunque eterozigoti per quella mutazione, e si è osservato come questi topini vivessero tranquillamente fino ad età avanzata quando, però, iniziavano a sorgere in alcuni di essi tumori mortali.
La situazione si faceva drammatica nel caso dei topini con entrambi gli alleli di p53 mutati (p53 -/-), questi infatti morivano precocemente, e tutti per tumore.
Per quanto riguarda la struttura della proteina p53 si riconoscono all’interno della proteina vari domini strutturali, ed in particolare vi è una regione, che consente il legame di tale proteina con il DNA, che risulta essere la più frequentemente mutata quando si vanno a ricercare mutazioni a carico di p53 nei tumori umani. Una mutazione a livello di questo dominio comporta una perdita di funzionalità della proteina in quanto, essendo un fattore trascrizionale, se mutato perde la propria attività trascrizionale perchè non è più in grado di riconoscere le sequenze all’interno della catena del DNA a cui potrebbe legarsi, con conseguente perdità funzionale.
P53 viene anche chiamato il guardiano del genoma, per sottolineare il ruolo fondamentale che ha nel controllo dello stato di salute della cellula. P53 può essere infatti attivato in seguito a numerosi segnali provenienti dalla cellula (danni al DNA, danno cellulare conseguente a iperattività degli oncogeni, o ad ipossia, o ad altre situazioni non fisiologiche, etc.) e come tutti i fattori trascrizionali svolge un ruolo importante, poiché controlla un pacchetto di geni che codificano per proteine molto importanti per il controllo cellulare.
Una volta attivato, p53 in una cellula sana è in grado di svolgere diversi compiti.
Ad esempio nel caso di un danno riparabile al DNA, che non deve essere duplicato per evitare che il danno venga trasmesso alle cellule figlie, p53 può:
- attivare l’espressione di geni che bloccano la proliferazione cellulare, ad esempio p21 (inibitore dei complessi ciclina/CDK);
- attivare geni che sono coinvolti nei meccanismi di riparo del danno al DNA (es. DNA polimerasi K).
Una volta che la cellula ha riparato il DNA, p53 si inattiva e la cellula può proliferare.
Nel caso di un danno non riparabile, p53 può:
- indurre l’apoptosi , attivando i geni preposti e dunque inducendo il suicidio di una cellula che presenta un DNA danneggiato irrimediabilmente;
- indurre senescenza, in modo che tale cellula non possa più replicare.
In particolar modo per quanto riguarda l’apoptosi esistono due distinti programmi che l’attivano: la via intrinseca e la via estrinseca.
La via estrinseca è attivata da FAS/FAS-ligando ma per quanto riguarda p53 la via che è interessata è la via intrinseca, che si basa sul rilascio di citocromo C da parte del mitocondrio che attiva la via delle caspasi, a partire dalla caspasi 9, che a sua volta determina poi l’attivazione di altre caspasi esecutrici del processo apoptotico.
La fuoriuscita del citocromo C dal mitocondrio è a sua volta regolata da una serie di proteine che hanno attività pro-apoptotica o anti-apoptotica.
Proteine pro-apoptotiche: sono le proteine che promuovono la fuoriuscita del citocromo C dal mitocondrio, come per esempio Bax e Bak, dando inizio ai processi che porteranno alla cascata di caspasi che indurrà l’apoptosi cellulare
Proteine anti-apoptotiche: proteine che inibiscono l’uscita del citocromo C, come Bcl-2
P53 controlla quindi il meccanismo di apoptosi favorendo l’espressione dei geni pro-apoptotici che inducono un aumento delle proteine pro-apoptotiche.

I tumori possono però adottare diverse strategie per evitare l’apoptosi, oltre alla mutazione di p53. Esistono infatti altri meccanismi, come l’aumento dell’espressione di proteine anti-apoptotiche, come Bcl-2 (ne è un esempio il linfoma follicolare a carico dei linfociti B, nei quali, a causa di una traslocazione cromosomica, il gene che codifica per Bcl2 viene a trovarsi sul braccio lungo del cromosoma 14, sotto il controllo delle sequenze regolatrici per le immunoglobuline).
In realtà una overespressione del gene Bcl-2 comporta sì un non suicido della cellula, ma ciò non è sufficiente per lo sviluppo di un tumore. Questa sarà quindi una sola tra le mutazioni che sommate consentiranno la trasformazione neoplastica. Se ad esempio oltre alla mutazione di Bcl-2 è presente anche una mutazione a livello di un oncogene, aumenterà notevolmente la probabilità di insorgenza di un tumore.
P53 svolge anche un ruolo nella produzione di proteine antiangiogeniche. Controlla infatti l’angiogenesi inducendo l’espressione di una proteina di matrice extracellulare, la trombospondina, che è un potente inibitore dei fenomeni di neovascolarizzazione.
Per quanto riguarda la regolazione di P53 essa viene sempre prodotta dalla cellula, per poi venire degradata. Se non serve, infatti, viene rapidamente eliminato: viene legato da una proteina, la proteina Mdm2, che legando p53 ne consente l’ubiquitinazione e la degradazione nel proteosoma.
In una cellula sana dunque, i livelli di p53 saranno estremamente bassi.
Nel caso in cui avvenga un danno al DNA, o altri tipi di danni, la situazione nella cellula cambia, perché si verifica un’attivazione di proteine, che a loro volta attivano delle chinasi responsabile della fosforilazione di p53, che una volta fosforilato non è più aggredibile dalla proteina Mdm2, e dunque non viene più degradato ma, al contrario, accumulato e trasferito poi nel nucleo dove svolgerà il suo ruolo di guardiano del genoma.
Se dunque p53 è mutato e non è in grado di legare il DNA, la cellula non si arresta più, non ripara il danno, non si suicida e non va in senescenza, tutte condizioni perfette per una cellula tumorale.
Anche in questo caso non è per forza necessario mutare p53, ma, come per Rb, ci sono strategie alternative che una cellula tumorale può intraprendere, come ad esempio inattivare MDM2, l’importante infatti è inattivare p53, a prescindere che avvenga direttamente o indirettamente.
L’inattivazione di p53 inoltre diviene purtroppo fondamentale anche nel momento in cui un tumore viene trattato terapicamente per eliminarlo, tramite radioterapia o chemioterapia.
Questo perché sia la radioterapia che la chemioterapia tendono ad uccidere le cellule tumorali provocando in esse danni che inducono l’apoptosi della cellula stessa, ma se una cellula ha p53 mutato, non è detto che si suicidi, quindi nei tumori con p53 mutato esiste la possibilità concreta che questi siano decisamente più resistenti alla radioterapia e alla chemioterapia.
Per questo motivo spesso tra le analisi di laboratorio che si attuano su pazienti affetti da tumore può rientrare l’analisi dello stato di p53, per poterne osservare l’eventuale mutazione e decidere il trattamento più adeguato.
Un’esempio di patologia provocata dalla mutazione di p53 è data dalla sindrome di Li-Fraumani, sindrome molto rara caratterizzata da una elevatissima incidenza di tumori diversi in un gran numero dei membri di una famiglia, spesso in giovane età. Tale patologia è legata ad un problema genetico strettamente associato col cancro associato alla mutazione appunto del gene che codifica per la proteina p53.
Immagini/Pictures
Fonti/Sources
!discovery 35
This post was shared and voted inside the discord by the curators team of discovery-it
Join our community! hive-193212
Discovery-it is also a Witness, vote for us here
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @steemstem account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.