Carcinogenic Chemicals - Cancerogeni Chimici
Carcinogens Chemicals

The initiating chemical carcinogens as mentioned above therefore interact with the DNA and most often originate the so-called adduct, i.e. a covalent bond is formed between the DNA and the carcinogen that leads to a deformation of the double helix structure.
To interact with the genome inside the nucleus the carcinogen must have two characteristics, i.e. it must be able to overcome cell membranes and must therefore be lipophilic (or able to exploit specific cellular transporters), and in addition to this characteristic, the molecule must be able to react with DNA (nucleophilic) and, in order to do so, it must also be electrophilic.
Substances with both characteristics are defined as direct starting chemical carcinogens.
However, there are a series of families of molecules that are not electrophilic in themselves, but which can interact with DNA only after modifications that the molecules undergo after entering the cell, more precisely when they are metabolized by the cytochrome p450.
These molecules in themselves are not carcinogenic, but it is we who make them so and they are defined as indirect chemical carcinogens or pro-carcinogens.
Our organism normally eliminates foreign (xenobiotic) molecules trying to make them as water-soluble as possible in order to get rid of them through urine or feces.
However, the problem is found when the xenobiotic molecule is an indirect initiating carcinogen: in fact, the metabolism of this substance makes it electrophilic and therefore able to interact with DNA.
As mentioned, the enzymatic complex of cytochrome p450 is the one that deals with this function within the cell, reducing these xenobiotic molecules to one or more primary metabolites.
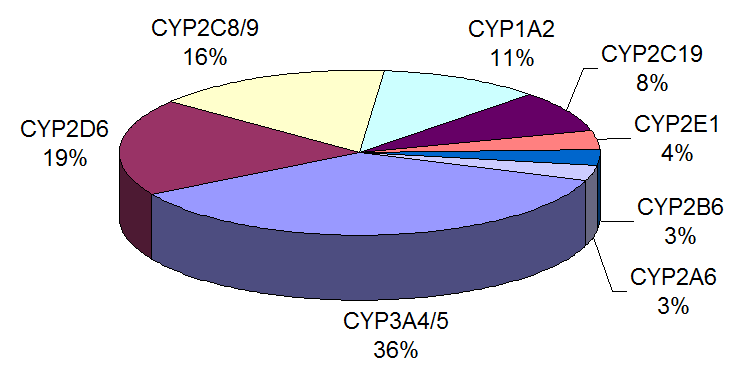
The enzymatic system of cytochrome p450 is highly complex and there are various types (which are coded by different genes) that can be classified into different subfamilies.
Each enzyme coded by these genes is different from the others in terms of function, substrate specificity and also in terms of tissue localization, so when we introduce a chemical carcinogen it is not said that it is metabolized in the same way by all tissues, as each tissue has its own spectrum of specific p450 cytochromes that metabolize the procarcinogens differently.
An important example of this is given by the β-naphthylamine: in mice this molecule did not give any symptoms, but in humans it caused bladder cancer.
It was then discovered that β-naphthylamine is a procancerous and, at liver level, the cytochrome p450 transforms it into a metabolite which, again in the liver, combines with glycuronic acid (GOH), thus becoming a water-soluble molecule which is then eliminated. In the human bladder, however, there is an enzyme (which the mouse lacks instead), able to free the metabolite from GOH, making it again an electrophilic metabolite able to react with DNA and therefore cause bladder cancer.
Although chemical carcinogens are unable to choose which gene to target, their conformational and chemical characteristics mean that DNA damage is relatively specific to each type of carcinogen.
Taking into account, for example, the alterations to gene p53 in lung cancer, it can be seen that point mutations caused by tobacco smoke (C→A) are present in 20% of non-smoking patients, 30% of smoking patients and 75% of smoking patients who are also exposed to coal.
As a result of all this, pharmaceutical companies, before putting a new drug or molecule on the market, are obliged to test whether the drug is carcinogenic or not, and a series of tests are carried out both in vitro and in vivo.
To perform the tests in vivo, at least two different species of guinea-pigs must be selected, and for each of them both sexes must be taken. This directive is due to the fact that some procarcinogens can be metabolized by certain p450 cytochromes that are inducible to hormonal stimulation, or that vary with age and diet.
The Ames Test is an in vitro test invented a few years ago, which allows, through a quick, simple and inexpensive screening, to determine whether a certain molecule is a mutagen or not. This test is performed on a type of mutated Salmonella that requires histidine in the culture broth to grow.
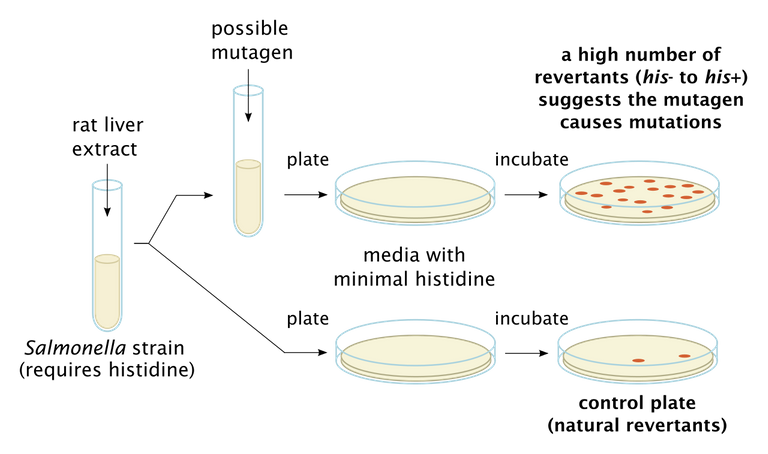
If we place Salmonella on a capsule with a culture broth in which histidine is not present, it obviously cannot grow;
If we treat this Salmonella (always in a culture broth without histidine) with a mutagen, we induce random mutations and it is possible that among all these mutations there are mutations that correspond to the retromutation, thus allowing the bacterium to grow.
This test, however, has the limit of working only for direct initiating chemical carcinogens and a modification has been applied to the test in order to be able to analyse also the procarcinogens: a cellular extract (usually hepatic) is added to the system, in order to incorporate also the p450 component and to be able to observe possible effects of the drug in vitro.
Promoting chemical carcinogens** as mentioned above are chemicals that do not act as mutagens, but are able to stimulate cell proliferation.
The first promoter to be discovered is Croton oil, of which it was observed that the component of this vegetable oil, responsible for the neoplastic promoter activity, was a scissor ester (TPA).
This molecule has a structure similar to diacylglycerol and, like this one, is able to activate the protein kinase C, which, once stimulated by diacylglycerol or TPA, activates signal transduction cascades within the cell capable of activating proliferation (NF-kB, AP-1 and MAP-Chinase).
The activation of kinase is not the only method used by the promoters, but different types of substances can go to inhibit active phosphatases against intermediate substrates that are defosphorylated during the C-kinase signal cascade.
Pictures
Sources
Cancerogeni Chimici

I cancerogeni chimici inizianti come detto interagiscono quindi con il DNA e il più delle volte originano il cosiddetto addotto, cioè si viene a formare un legame covalente tra il DNA e il cancerogeno che porta ad una deformazione della struttura della doppia elica.
Per interagire con il genoma all’interno del nucleo il cancerogeno deve godere di due caratteristiche, ovvero deve poter superare le membrane cellulari e deve essere quindi lipofila (o in grado di sfruttare trasportatori specifici cellulari), e oltre a questa caratteristica, la molecola deve essere in grado di reagire con il DNA (nucleofilo) e, per poterlo fare, ha bisogno di essere anche elettrofila.
Le sostanze che presentano fin da subito entrambe le caratteristiche vengono definite cancerogeni chimici inizianti diretti.
Esistono però una serie di famiglie di molecole che di per sé non sono elettrofile, ma che possono interagire con il DNA solo dopo modificazioni a cui le molecole vanno incontro dopo essere entrate nella cellula, più precisamente quando vengono metabolizzate dal citocromo p450.
Queste molecole di per sé non sono cancerogene, ma siamo noi che le rendiamo tali e vengono definite cancerogeni chimici indiretti o procancerogeni.
Il nostro organismo, normalmente, elimina le molecole estranee (xenobiotiche) cercando di renderle il più idrosolubili possibile per potersene liberare attraverso l’urina o le feci.
Il problema si riscontra però quando la molecola xenobiotica è un cancerogeno iniziante indiretto: infatti il metabolismo di questa sostanza la rende elettrofila e quindi in grado di interagire con il DNA.
Come accennato il complesso enzimatico del citocromo p450 è quello che si occupa di questa funzione all’interno della cellula, riducendo queste molecole xenobiotiche ad uno o più metaboliti primari.
Il sistema enzimatico del citocromo p450 risulta altamente complesso e ne esistono varie tipologie (che sono codificate da diversi geni) che possono essere classificate in diverse sottofamiglie.
Ogni enzima codificato da questi geni è diverso dagli altri per funzione, specificità di substrato e anche in termini di localizzazione tissutale, quindi quando introduciamo un cancerogeno chimico non è detto che questo venga metabolizzato allo stesso modo da tutti i tessuti, in quanto ciascun tessuto ha il suo spettro di citocromi p450 specifici che metabolizzano in maniera diversa i procancerogeni.

Un esempio importante di quanto appena detto è dato dalla β-naftilamina: nei topi questa molecola non dava nessun sintomo, ma nell’uomo provocava cancro alla vescica.
Si è scoperto poi che la β-naftilamina è un procancerogeno e, a livello epatico, il citocromo p450 lo trasforma in un metabolita che, sempre nel fegato, si coniuga con l’acido glicuronico (GOH), diventando così una molecola idrosolubile che verrà poi eliminata. Nella vescica dell’uomo però è presente un enzima (che manca invece al topo), in grado di liberare il metabolita dal GOH, rendendolo nuovamente un metabolita elettrofilo in grado di reagire con il DNA e provocare perciò il cancro alla vescica.
Nonostante i cancerogeni chimici non siano in grado di scegliere quale gene colpire, le loro caratteristiche conformazionali e chimiche fanno sì che il danno al DNA sia relativamente specifico per ogni tipo di cancerogeno.
Prendendo ad esempio in considerazione le alterazioni a carico del gene p53 nei tumori polmonari, si può notare che le mutazioni puntiformi causate dal fumo di tabacco (C→A) sono presenti nel 20% dei pazienti non fumatori, nel 30% dei pazienti fumatori e nel 75% dei pazienti fumatori che sono esposti anche al carbone.
In virtù di tutto ciò le industrie farmaceutiche, prima di mettere un nuovo farmaco o una nuova molecola sul mercato, sono obbligate a saggiare se il farmaco sia cancerogeno o no, e per poterlo fare vengono eseguiti una serie di test sia in vitro sia in vivo.
Per eseguire i test in vivo bisogna selezionare almeno due specie di cavie diverse, e per ognuna di esse devono essere presi entrambi i sessi. Questa direttiva è dovuta al fatto che alcuni procancerogeni possono essere metabolizzati da determinati citocromi p450 che sono inducibili da stimolazioni ormonali, o che variano con l’età e con la dieta.
Il Test di Ames è un test in vitro inventato qualche anno fa, che permette, tramite uno screening rapido, semplice ed economico, di capire se una determinata molecola sia un mutageno oppure no. Questo test è eseguito su un tipo di Salmonella mutata che richiede istidina nel brodo di coltura per poter crescere.

Se inseriamo la Salmonella su una capsula con un brodo di coltura in cui non è presente l’istidina, ovviamente essa non riesce a crescere;
Se trattiamo questa Salmonella (sempre nel brodo di coltura privo di istidina) con un mutageno, induciamo mutazioni casuali ed è possibile che tra tutte queste siano presenti mutazioni che corrispondono alla retromutazione, permettendo così al batterio di crescere.
Questo test ha però il limite di funzionare solo per i cancerogeni chimici inizianti diretti e per poter analizzare anche i procancerogeni è stata applicata una modifica al test: viene aggiunto al sistema un estratto cellulare (di solito epatico), in modo da andare ad incorporare anche la componente p450 e poter così osservare possibili effetti del farmaco in vitro.
I cancerogeni chimici promoventi come accennato pima sono sostanze chimiche che non svolgono la funzione di mutageni, ma sono in grado di stimolare la proliferazione cellulare.
Il primo promovente ad essere stato scoperto è l’olio di Croton, di cui si è osservato che la componente di quest’olio vegetale, responsabile dell’attività promovente neoplastica, era un estere del forbolo (TPA).
Questa molecola ha una struttura simile al diacilglicerolo e, come questa, è in grado di attivare la protein chinasi C, la quale una volta stimolata dal diacilglicerolo o dal TPA, attiva delle cascate di trasduzione del segnale all’interno della cellula in grado di attivare la proliferazione (NF-kB, AP-1 e MAP-Chinasi).
L’attivazione della chinasi non è il solo metodo utilizzato dai promoventi, ma diversi tipi di sostanze possono andare ad inibire delle fosfatasi attive nei confronti di substrati intermedi che vengono defosforilati durante la cascata di segnali della chinasi C.
Immagini
Fonti
@tipu curate
Upvoted 👌 (Mana: 0/4)
!discovery 40
This post was shared and voted inside the discord by the curators team of discovery-it
Join our community! hive-193212
Discovery-it is also a Witness, vote for us here
This post was shared in the Curation Collective Discord community for curators, and upvoted and reblogged by the @c-squared community account after manual review.
@c-squared runs a community witness. Please consider using one of your witness votes on us here
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.