[ESP/ENG] BREVE ESTUDIO DE LOS POLIMEROS parte 3a de 3 /BRIEF STUDY OF POLYMERS part 3a of 3 by @nahumsamuel
Es un gusto saludar a todos mis amigos de @stemsocial. Ya lo he dicho antes, pero lo ratifico, es para mí de mucho agrado poder participar en esta linda comunidad de conocimiento y ciencia. De una manera muy grata he hallado un lugar entre ustedes para poder compartir mis estudios y conocimientos.
 |
En esta ocasión les traigo la 3ra entrega de 3 tomos acerca de un breve estudio de los polímeros. Lo único es que no pude prever que el último capítulo era muy extenso y por esto decidí dividir en dos la sección de polimerización, con intención de no abrumarles con tanta información. Les ruego sepan entender y disculparme y a continuación les traigo la parte 3-a de esta rica y linda serie de Los Polímeros.
Polimerización
Es un proceso químico por el cual, mediante calor, luz o un catalizador, se unen varias moléculas de un compuesto generalmente de carácter no saturado llamado monómero para formar una cadena de múltiples eslabones, moléculas de elevado peso molecular y de propiedades distintas, llamadas macromoléculas o polímeros4.
Tipos de reacciones de polimerización
Hay dos reacciones generales de polimerización: la de adición y la condensación. En las polimerizaciones de adición, todos los átomos de monómero se convierten en partes del polímero. En las reacciones de condensación, algunos de los átomos del monómero no forman parte del polímero, sino que son liberados como H2O, CO2, ROH, etc4.
1)Polimerización por condensación
La polimerización por condensación ocurre por etapas y en la mayoría de los casos debido a la reacción entre grupos funcionales diferentes. Es una polimerización en etapas pues la macromolécula se forma a través de la reacción de los monómeros, dímeros, trímeros y oligómeros obteniéndose frecuentemente productos secundarios como por ejemplo el agua, la que debe ser retirada a medida que la reacción procede4.
A manera de ejemplos podemos citar:
a) Poliésteres (poliácidos + polialcoholes)
b) Poliamidas (poliácidos + poliamidas)
c) Uréicas (urea + formol)
d) Melamínicas (melamina + formol)
e) Policarbonatos (bisfenol A + fosgeno)
f) Epoxi (bisfenol A + epiclorhidrina)
g) Fenólicas (fenol + formol)5
Las características principales de este tipo de polimerización son las siguientes:
• Muchas veces es una reacción extremadamente lenta que necesita varias horas para completarse.
• Todos los monómeros son rápidamente convertidos a dímeros, trímeros y oligómeros, lo cual significa que en todo momento la concentración de cadenas en crecimiento es alta y baja la concentración monomérica.
• Debido al hecho que la mayoría de las reacciones químicas involucradas en este tipo de polimerización poseen altas energías de activación, la polimerización es usualmente lleva a cabo a altas temperaturas.
• Los pesos moleculares obtenidos utilizando este tipo de polimerización son moderados (usualmente inferiores a 20000).
• La linealidad, ramificación y grado de entrecruzamiento del polímero son parámetros fácilmente controlables en función de la composición química de la mezcla de monómeros.
• Generalmente un solo tipo de reacción química es responsable por la polimerización.
• En general los polímeros obtenidos por condensación presentan una amplia distribución de pesos moleculares, los cuales significa que son altamente polidispersos.
La formación de una cadena polimérica puede ser conseguida a través de la homopolimerización de un monómero difuncional, generalmente con grupos funcionales diferentes y que puedan reaccionar entre sí o por el contrario como consecuencia de la copolimerización de dos monómeros difuncionales cada uno de ellos con grupos funcionales diferentes.
Las resinas de tipo alquídicas constituyen un ejemplo importante de polímeros sintetizados por el mecanismo de condensación y obtenidas a través de mezclas monoméricas de este tipo4.
2)Polimerización por Adición
Los polímeros obtenidos por polimerización por adición son mucho más importantes en la industria de la pintura. Los polímeros sintetizados por este mecanismo, se utilizan como vehículos para pinturas automotrices, arquitectónica, industriales, etc.
La polimerización por adición es también conocida como polimerización en cadena, siendo caracterizada por la adición de un monómero a una especie química activada especie esta que puede ser un monómero activado o una cadena polimérica en crecimiento. Es una polimerización que necesita de un catalizador o iniciador, pues la mayoría de las veces no es una reacción espontánea4.
Polimerización radical en cadena
En una polimerización en cadena típica, una reacción de iniciación puede dar lugar a la polimerización de cientos de moléculas monómeras.
Las características de la polimerización en cadena, sugieren que el centro activo responsable del crecimiento de la cadena está asociado con una única molécula polímera mediante la adición de muchas unidades del monómero. Por este motivo, las moléculas de polímero se forman desde el comienzo y casi no se encuentran especies intermedias entre el monómero y el polímero de alto peso molecular4.
Generación de radicales libres
Algunas reacciones orgánicas tienen lugar a través de intermediarios, que poseen un número impar de electrones y consecuentemente un electrón desapareado. Tales intermediarios se conocen como radicales libres. Pueden obtenerse por distintos caminos que incluyen la descomposición térmica de peróxidos orgánicos o hidroperóxidos o compuestos azo o diazo. Otras formas de generación de radicales libres, ocasionalmente utilizadas para iniciar la polimerización, incluyen la descomposición fotolítica de compuestos con enlaces covalentes; la disociación de enlaces covalentes por radiación de alta energía; reacciones de oxidación-reducción; iniciación electroquímica.
Una reacción corrientemente usada para producir radicales para polimerización es la descomposición térmica o fotoquímica de peróxido de benzoilo:
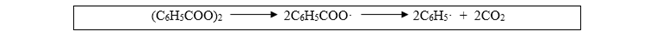
La estabilidad de los radicales varía ampliamente. Los radicales primarios son menos estables y más reactivos que los radicales secundarios, los cuales son a su vez menos estables que los terciarios. Algunos radicales terciarios, tales como el trifenilmetilo, pueden aislarse en estado sólido sin descomponerse. El radical fenilo es más reactivo que el radical bencilo, el radical alilo es mucho menos reactivo, y así sucesivamente4-19.
Iniciación
Cuando se generan radicales libres en presencia de un monómero vinílico, el radical se adiciona al doble enlace con la producción de otro radical. Si el radical formado por la descomposición del iniciador I se designa por R·,
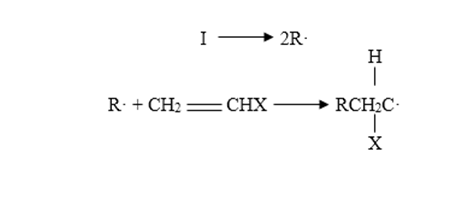
La regeneración del radical es característica de las reacciones en cadena.
El mecanismo radical de la polimerización por adición se evidencia no solo por la capacidad de los radicales para acelerar la polimerización vinílica, sino también por la demostración de que los polímeros así formados contienen fragmentos de los radicales. La presencia de átomos pesados, tales como el bromo o el iodo, o átomos radioactivos en el iniciador, se ha utilizado para demostrar muchas veces que dan lugar a polímeros a partir de los cuales estos átomos no pueden ser eliminados.
La eficacia con la que los radicales inician las cadenas puede estimarse por comparación de la cantidad del iniciador descompuesto con el número de cadenas polímeras formadas. La descomposición del iniciador puede, corrientemente, seguirse por métodos analíticos. El método más directo para encontrar la eficacia del iniciador entonces depende de analizar en el polímero los fragmentos del iniciador. Esto no es difícil en aquellos casos en los que el iniciador deja un grupo terminal reactivo sobre el polímero, o esté marcado radioactivamente.
En otras polimerizaciones es más útil determinar el número de moléculas de polímero formadas a partir del peso molecular medio en número del polímero. Queda otra alternativa, algunas veces de validez dudosa, y es hacer reaccionar la cadena radical estequiométricamente con un inhibidor. La mayor parte de los iniciadores en las polimerizaciones vinílicas típicas tienen eficacias entre 0,6 y 1,0; es decir, entre el 60 y el 100% de todos los radicales últimamente formados inician cadenas polímeras. La causa más acusada de baja eficacia es la recombinación de los pares de radicales antes de que puedan alejarse uno de otro (efecto jaula). Una vez iniciada la reacción entre el radical libre y el monómero (iniciación) el tiempo total para completar una molécula polimérica es del orden de las fracciones de segundo4-19.
Propagación
La cadena radical formada en la etapa de iniciación es capaz de adicionar monómeros sucesivos para propagar dicha cadena:
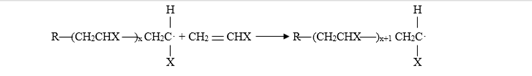
Terminación
La propagación podría continuar hasta que el suministro de monómero se agotase, si no fuera por la fuerte tendencia de los radicales para reaccionar en pares formando un enlace covalente de electrones apareados con pérdida de la actividad del radical. Esta tendencia es compensada en una polimerización radical por la pequeña concentración de especies radicales comparada con la de los monómeros.
La etapa de terminación puede tener lugar de dos formas:
Combinación o acoplamiento:
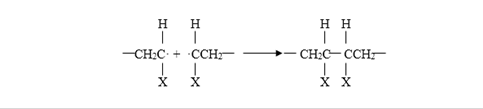
En este caso los extremos de las dos cadenas en crecimiento pueden unirse generándose una sola cadena larga a partir de dos más cortas4-19.
Desproporción:
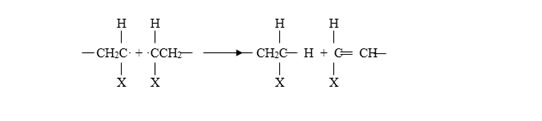
El extremo activo de una cadena puede quitar un átomo de hidrógeno de otra formando dos cadenas en vez de combinarlas en otras más largas. De esta forma el hidrógeno se transfiere dando como resultado la formación de dos moléculas en las que se producen, en una, un grupo insaturado terminal, y en la otra, uno saturado. Se conoce cada tipo de terminación. Los estudios del número de fragmento de iniciador por molécula, muestran que el poliestireno termina, predominantemente, por combinación, mientras que el poli (metacrilato de metilo), termina totalmente por desproporción a temperaturas de polimerización superiores a 60°C, y parcialmente por cada uno de los mecanismos a temperaturas más bajas1.
El peso molecular del polímero en este tipo de polimerización es determinado por la composición monomérica y las condiciones del proceso. De esta forma, las variables que más afectan al peso molecular son:
• Concentración del iniciador
• Temperatura
• Concentración monomérica durante la reacción
• Presencia de agente de transferencia de cadena
De forma general, podemos decir que cuanto mayor es la concentración del iniciador, menor será el peso molecular del polímero. También, dentro de ciertos límites podemos asegurar que temperaturas más altas resulta en pesos moleculares menores (la reacción de terminación es favorecida frente a la propagación a altas temperaturas)1.
Altas concentraciones de monómeros producen polímeros en solución de alto peso molecular, mientras que cuando la concentración monomérica es baja los pesos moleculares del polímero también son bajos4.
Generación de radicales libres
La generación de radicales libres necesaria para iniciar la polimerización puede ser hecha de diferentes formas:
• Acción del calor
• Irradiación
• Descomposición térmica de compuestos orgánicos adecuados
• Proceso redox4-19
Otras formas de la polimerización por adición
Es necesario puntualizar que no todas las formas de iniciación pueden ser utilizadas con los monómeros. La polimerización por adición ocurre a través de la doble ligadura carbono- carbono localizada en el extremo del monómero.
Tabla 1. Grupo de monómeros y sus alternativas de polimerización por adición
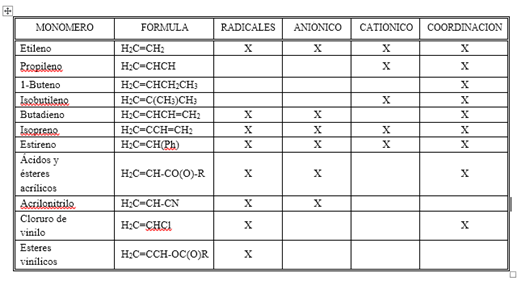
No todos los compuestos químicos que poseen una doble o triple ligadura en la extremidad de la cadena pueden ser polimerizados vía radicales libres ya que puede favorecer o inhibir la polimerización. Así cuando simultáneamente x e y son radicales alquilo mayores que - CH3 la polimerización ocurre lentamente o es inhibida.
Los acrilatos polimerizan más rápidamente que los metacrilatos pues en los primeros uno de los sustituyentes es H mientras que en los metacrilatos el sustituyente es metilo. Lo mismo sucede con el estireno y el α-metil-estireno. El primero polimeriza más rápidamente. La doble ligadura C=C sufre resonancia.
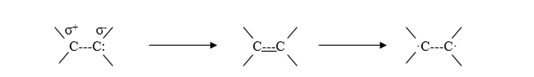
Esta resonancia explica porqué a través de la doble ligadura se puede producir la polimerización por adición por un proceso iónico o por radicales libres. El sustituyente altera la densidad electrónica de la doble ligadura, estabilizando el posible radical, anión o catión lo cual favorecerá un determinado tipo de polimerización.
La polimerización catiónica es favorecida cuando un sustituyente tiene carácter inductivo y al mismo tiempo estabiliza la especie catiónica a través de diferentes formas de resonancia.
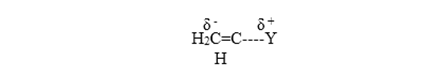
Son ejemplos de este tipo de monómeros: estireno, isobutileno, isopreno, etc.
Una polimerización aniónica es favorecida cuando el sustituyente disminuye la densidad electrónica sobre la doble ligadura.
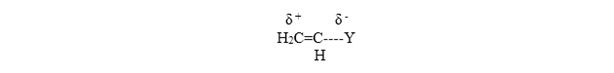
Son ejemplos de este tipo de sustituyentes los grupos carbonilo (provenientes de cetonas, ácidos o ésteres), nitrilos, etc.
El proceso de iniciación vía radicales libres es él más frecuente pues los iniciadores no son tan selectivos y pueden actuar sobre doble ligaduras carbono-carbono, independientemente de la naturaleza inductiva de los sustituyentes.
Al mismo tiempo una estabilización de los radicales formados ocurre en la mayoría de los casos, lo cual favorece la polimerización. Acrilonitrilo, acrilatos y metacrilatos son buenos ejemplos de monómeros que posibilitan una estabilización satisfactoria de los respectivos radicales libres3.
A continuación, se pueden ver las diferentes formas de polimerización en cadena y las respectivas especies químicas de iniciadores en cada caso:
Tabla 2. Especies iniciadoras para cada tipo de polimerización por adición
Son ejemplos de ácidos de Lewis: Trifluoruro de boro y tricloruro de aluminio
BIBLIOGRAFÍA
1 Askeland, D. R. (1998). Ciencia e Ingeniería de los Materiales (3era ed.). México: International Thompson Editores.
2 Bayer, E. M. (1965). Química de los Materiales Plásticos. España: Editorial Científico-Médica.
3 Beyer, F. (2003). Química de los Polímeros. México: Claryant, S.A.
4 Billmeyer, F. W. (1975). Ciencia de los Polímeros. Barcelona: Editorial Reverté, S.A.
5 Carraher, C. E. y Seymour, R. B. (1995). Introducción a la Química de los Polímeros. Barcelona: Editorial Reverté, S. A.
6 Cruz A. S. (2003). “Fundición Escultórica. El Poliestireno Expandido, Materia Gasificante”. Trabajo de grado no publicado. Universidad de Granada. España.
7 Dubois, J. H. y Pribble, W. I. (1999). Enciclopedia de la Química Industrial. Ingeniería de Moldes para Plásticos. (Tomo 5). España: Ediciones URMO, S.A.
8 Encyclopedia of Physical Science and Technology. (2003). Polymers (3th ed.). New York: Hoboken.
9 Hanbook of Plastics Joining. (1997). Norwich, New York: Plastics Desing Library.
.jpg)
Un agradecimiento especial a las comunidades que me han dado su apoyo, @la-colmena, @cervantes, @ecency, @stem-social y @steemstem.

[INGLÉS]
It is a pleasure to say hello to all my friends at @stemsocial. I have already said it before, but I confirm it, it is a great pleasure for me to be able to participate in this beautiful community of knowledge and science. In a very pleasant way I have found a place among you to be able to share my studies and knowledge.
 |
This time I bring you the 3rd installment of 3 volumes about a brief study of polymers. The only thing is that I could not foresee that the last chapter was very long and for this reason I decided to divide the polymerization section in two, with the intention of not overwhelming you with so much information. I beg you to understand and apologize and then I bring you part 3-a of this rich and beautiful series of Los Polímeros.
Polymerization
It is a chemical process by which, by means of heat, light or a catalyst, several molecules of a generally unsaturated compound called monomer join to form a chain of multiple links, high molecular weight molecules with different properties, called macromolecules. or polymers4.
Types of polymerization reactions
There are two general polymerization reactions: addition and condensation. In addition polymerizations, all monomer atoms become parts of the polymer. In condensation reactions, some of the monomer atoms are not part of the polymer, but are released as H2O, CO2, ROH, etc4.
1)Condensation polymerization
Condensation polymerization occurs in stages and in most cases due to the reaction between different functional groups. It is a polymerization in stages since the macromolecule is formed through the reaction of monomers, dimers, trimers and oligomers, frequently obtaining secondary products such as water, which must be removed as the reaction proceeds4.
As examples we can cite:
a) Polyesters (polyacids + polyalcohols)
b) Polyamides (polyacids + polyamides)
c) Ureic (urea + formaldehyde)
d) Melamine (melamine + formaldehyde)
e) Polycarbonates (bisphenol A + phosgene)
f) Epoxy (bisphenol A + epichlorohydrin)
g) Phenolic (phenol + formaldehyde) 5
The main characteristics of this type of polymerization are the following:
• Many times it is an extremely slow reaction that takes several hours to complete.
• All monomers are rapidly converted to dimers, trimers and oligomers, which means that at all times the concentration of growing chains is high and the monomer concentration is low.
• Due to the fact that most of the chemical reactions involved in this type of polymerization have high activation energies, polymerization is usually carried out at high temperatures.
• The molecular weights obtained using this type of polymerization are moderate (usually less than 20,000).
• The linearity, branching and degree of crosslinking of the polymer are easily controllable parameters depending on the chemical composition of the monomer mixture.
• Generally only one type of chemical reaction is responsible for polymerization.
• In general, the polymers obtained by condensation have a wide distribution of molecular weights, which means that they are highly polydisperse.
The formation of a polymer chain can be achieved through the homopolymerization of a difunctional monomer, generally with different functional groups that can react with each other or, on the contrary, as a consequence of the copolymerization of two difunctional monomers, each with functional groups. different.
Alkyd-type resins are an important example of polymers synthesized by the condensation mechanism and obtained through monomeric mixtures of this type4.
2)Addition Polymerization
Polymers obtained by addition polymerization are much more important in the paint industry. The polymers synthesized by this mechanism are used as vehicles for automotive, architectural, and industrial paints, etc.
Addition polymerization is also known as chain polymerization, being characterized by the addition of a monomer to an activated chemical species, which can be an activated monomer or a growing polymer chain. It is a polymerization that requires a catalyst or initiator, since most of the time it is not a spontaneous reaction4.
Radical chain polymerization
In a typical PCR, an initiation reaction can lead to the polymerization of hundreds of monomer molecules.
The characteristics of chain polymerization suggest that the active center responsible for chain growth is associated with a single polymer molecule by adding many units of the monomer. For this reason, polymer molecules are formed from the beginning and there are almost no intermediate species between the monomer and the high molecular weight polymer4.
Generation of free radicals
Some organic reactions take place through intermediaries, which have an odd number of electrons and consequently an unpaired electron. Such intermediates are known as free radicals. They can be obtained by different ways that include the thermal decomposition of organic peroxides or hydroperoxides or azo or diazo compounds. Other forms of free radical generation, occasionally used to initiate polymerization, include photolytic decomposition of covalently bonded compounds; the dissociation of covalent bonds by high energy radiation; oxidation-reduction reactions; electrochemical initiation.
A commonly used reaction to produce radicals for polymerization is the thermal or photochemical decomposition of benzoyl peroxide:
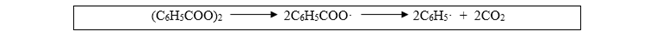
The stability of radicals varies widely. Primary radicals are less stable and more reactive than secondary radicals, which are in turn less stable than tertiary ones. Some tertiary radicals, such as triphenylmethyl, can be isolated in the solid state without decomposing. The phenyl radical is more reactive than the benzyl radical, the allyl radical is much less reactive, and so on4-19.
Initiation
When free radicals are generated in the presence of a vinyl monomer, the radical adds to the double bond with the production of another radical. If the radical formed by the decomposition of initiator I is designated by R ·,

Radical regeneration is characteristic of chain reactions.
The radical mechanism of addition polymerization is evidenced not only by the ability of radicals to accelerate vinyl polymerization, but also by the demonstration that the polymers thus formed contain fragments of the radicals. The presence of heavy atoms, such as bromine or iodine, or radioactive atoms in the initiator, has been used to demonstrate many times that they give rise to polymers from which these atoms cannot be removed.
The efficiency with which radicals initiate chains can be estimated by comparing the amount of initiator decomposed with the number of polymer chains formed. The decomposition of the initiator can, currently, be followed by analytical methods. The most direct method of finding the efficacy of the initiator then depends on analyzing the initiator fragments in the polymer. This is not difficult in those cases where the initiator leaves a reactive end group on the polymer, or is radioactively labeled.
In other polymerizations it is more useful to determine the number of polymer molecules formed from the number average molecular weight of the polymer. Another alternative remains, sometimes of doubtful validity, and that is to react the radical chain stoichiometrically with an inhibitor. Most of the initiators in typical vinyl polymerizations have efficiencies between 0.6 and 1.0; that is, between 60 and 100% of all recently formed radicals initiate polymer chains. The most pronounced cause of low efficiency is the recombination of the radical pairs before they can move away from each other (cage effect). Once the reaction between the free radical and the monomer has started (initiation), the total time to complete a polymer molecule is of the order of fractions of a second4-19.
Spread
The radical chain formed in the initiation stage is capable of adding successive monomers to propagate said chain:

Termination
Propagation could continue until the monomer supply was exhausted, were it not for the strong tendency of radicals to react in pairs forming a covalent bond of paired electrons with loss of radical activity. This tendency is compensated in radical polymerization by the small concentration of radical species compared to that of monomers.
The completion stage can take place in two ways:
Combination or coupling:

In this case, the ends of the two growing chains can join, generating a single long chain from two shorter ones4-19.
Disproportion:

The active end of one chain can remove a hydrogen atom from another by forming two chains instead of combining them into longer ones. In this way, hydrogen is transferred, resulting in the formation of two molecules in which a terminal unsaturated group is produced, and in the other, a saturated group. Each type of termination is known. Studies of the number of initiator fragment per molecule show that polystyrene predominantly terminates by combination, whereas poly (methyl methacrylate) terminates totally disproportionately at polymerization temperatures above 60 ° C, and partially for each one of the mechanisms at lower temperatures1.
The molecular weight of the polymer in this type of polymerization is determined by the monomer composition and the process conditions. Thus, the variables that most affect molecular weight are:
• Initiator concentration
• Temperature
• Monomeric concentration during the reaction
• Presence of chain transfer agent
In general, we can say that the higher the concentration of the initiator, the lower the molecular weight of the polymer. Also, within certain limits we can ensure that higher temperatures result in lower molecular weights (the termination reaction is favored over propagation at high temperatures) 1.
High concentrations of monomers produce polymers in solution of high molecular weight, while when the monomeric concentration is low, the molecular weights of the polymer are also low4.
Generation of free radicals
The generation of free radicals necessary to initiate polymerization can be done in different ways:
• Action of heat
• Irradiation
• Thermal decomposition of suitable organic compounds
• Redox process4-19
Other forms of addition polymerization
It is necessary to point out that not all forms of initiation can be used with monomers. Addition polymerization occurs through the carbon-carbon double bond located at the end of the monomer.
Table 1. Group of monomers and their addition polymerization alternatives

Not all chemical compounds that have a double or triple bond at the end of the chain can be polymerized via free radicals since it can promote or inhibit polymerization. Thus when simultaneously x and y are alkyl radicals greater than -CH3, polymerization occurs slowly or is inhibited.
Acrylates polymerize faster than methacrylates since in the former one of the substituents is H while in methacrylates the substituent is methyl. The same is true for styrene and α-methyl styrene. The former polymerizes more quickly. The C = C double bond undergoes resonance.

This resonance explains why, through double bonding, addition polymerization can occur by an ionic process or by free radicals. The substituent alters the electronic density of the double bond, stabilizing the possible radical, anion or cation, which will favor a certain type of polymerization.
Cationic polymerization is favored when a substituent has an inductive character and at the same time stabilizes the cationic species through different forms of resonance.
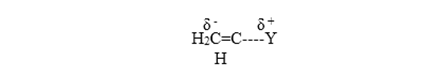
Examples of this type of monomers are: styrene, isobutylene, isoprene, etc.
An anionic polymerization is favored when the substituent decreases the electron density on the double bond.
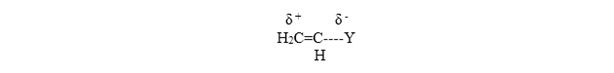
Examples of this type of substituent are carbonyl groups (from ketones, acids or esters), nitriles, etc.
The initiation process via free radicals is the most frequent since the initiators are not so selective and can act on carbon-carbon double bonds, regardless of the inductive nature of the substituents.
At the same time a stabilization of the radicals formed occurs in most cases, which favors the polymerization. Acrylonitrile, acrylates and methacrylates are good examples of monomers that allow a satisfactory stabilization of the respective free radicals3.
Below, you can see the different forms of chain polymerization and the respective chemical species of initiators in each case:
Table 2. Initiator species for each type of addition polymerization

Examples of Lewis acids are: Boron trifluoride and aluminum trichloride
BIBLIOGRAPHY
1 Askeland, D. R. (1998). Materials Science and Engineering (3rd ed.). Mexico: International Thompson Editores.
2 Bayer, E. M. (1965). Chemistry of Plastic Materials. Spain: Scientific-Medical Editorial.
3 Beyer, F. (2003). Polymer Chemistry. Mexico: Claryant, S.A.
4 Billmeyer, F. W. (1975). Polymer Science. Barcelona: Editorial Reverté, S.A.
5 Carraher, C. E. and Seymour, R. B. (1995). Introduction to Polymer Chemistry. Barcelona: Editorial Reverté, S. A.
6 Cruz A. S. (2003). Sculptural Foundry. Expanded Polystyrene, Gasifying Matter ”. Grade job did not publish yet. University of Granada. Spain.
7 Dubois, J. H. and Pribble, W. I. (1999). Encyclopedia of Industrial Chemistry. Engineering of Molds for Plastics. (Volume 5). Spain: Ediciones URMO, S.A.
8 Encyclopedia of Physical Science and Technology. (2003). Polymers (3rd ed.). New York: Hoboken.
9 Hanbook of Plastics Joining. (1997). Norwich, New York: Plastics Design Library.
.jpg)
A special thanks to the communities that have given me their support, @la-colmena, @ecency, @cervantes, @stem-social and @steemstem.
Que buena informacion, encaja excelente en la comunidad. Muchos exitos Nahum
gracias yrmaleza. seguiremos aportando
Excelentes aportes amigo @nahumsamuel, muy completo tu contenido, seguiremos leyéndonos, que tengas un excelente día.
gracias mi amigo. Estaremos leyendonos