Solvatación
Como bien sabemos, cuando hablamos de disolver una sustancia en otra hacemos referencia a un proceso en el cual la sustancia que se disuelve, el soluto, se dispersa y reparte homogéneamente en la otra que se encuentra en mayor proporción, el solvente. Ahora bien, la solvatación es la formación de interacciones entre las moléculas o iones del soluto con las moléculas del disolvente, que hacen que las moléculas de soluto queden rodeadas por capas de moléculas de solvente, desapareciendo en la solución.

Cuando un soluto se disuelve sus moléculas se dispersan e interacctuan con las moléculas del solvente. Fuente: @emiliomoron.
Por ejemplo, si disolvemos sal de mesa (NaCl) en agua, los iones sodio (Na+), que se producen por la disociación del NaCl, tienden a ser atraídos por la parte con carga negativa de algunas moléculas de agua, mientras que los iones cloro (Cl-) son atraídos por la parte con carga positiva de otras moléculas de agua, y mediante esta atracción de los iones que componen la red cristalina de la sal por parte de las moléculas de agua, el agua va disolviendo gradualmente los cristales de sal.
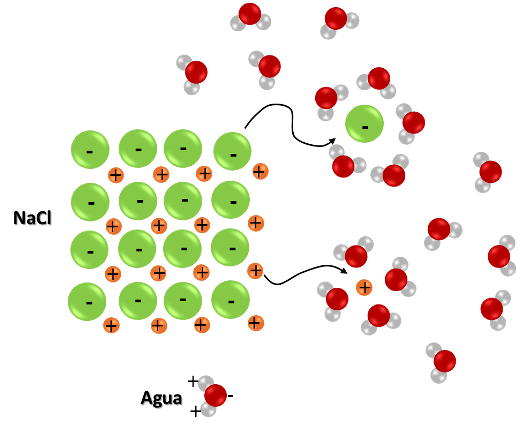
Los iones producidos en la disociación son atraidos por las moléculas del disolvente. Fuente: @emiliomoron.
Solvatación y papel del solvente
Entonces, podemos decir que la solvatación es un mecanismo de disolución en la cual los iones y moléculas del soluto son atraídos y rodeados por las moléculas del solvente producto de las interacciones que se forman entre estos. Este proceso tiene lugar cuando un compuesto iónico como el NaCl o un compuesto polar se disuelven en un solvente polar, sin que ocurran reacciones químicas.
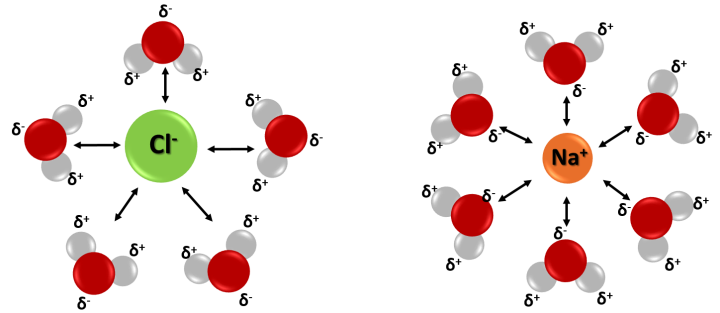
En la solvatación los iones o moléculas de soluto son rodeados por las moléculas de disolvente debido a las interacciones electrostáticas. Fuente: @emiliomoron.
Por lo tanto, la polaridad del solvente es el factor determinante para establecer su capacidad para disolver determinado soluto. Los disolventes polares son aquellos que tienen mayor densidad de electrones en una parte de la molécula, lo que les permite experimentar una carga parcialmente negativa en ese lado, dejando otro lado de la molécula experimentando una carga parcialmente positiva.
De este modo, las moléculas de los solventes polares pueden disolver sustancias iónicas o con moléculas que también exhiben polaridad, ya que pueden orientar la parte de la molécula con carga hacia el soluto mediante interacciones electrostáticas. Estas interacciones estabilizan el sistema, creando lo que se denomina una cascara de solvatación alrededor de cada molécula del soluto, que funciona como una capa protectora que impide que los iones o moléculas del soluto se vuelvan a unir.
En el proceso de solvatación, el solvente interactúa fuertemente con las moléculas ionizadas o con carga del soluto mediante la formación de enlaces dipolo-dipolo, puentes de hidrógeno y fuerzas de Van der Waals, y de acuerdo a la naturaleza e intensidad de estas fuerzas dependen propiedades del soluto como la solubilidad, influyendo además en propiedades del solvente como la densidad y la viscosidad.
Por otro lado, un disolvente no polar es aquel que es eléctricamente neutro, y este tipo de solventes solo sirven para disolver solutos que también son no polares, por eso el aceite de cocina no sirve para disolver compuestos como sal o azúcar, y también por eso decimos que el agua y el aceite no se mezclan, ya que el agua tampoco se puede disolver en el aceite.
Proceso de solvatación
Antes de agregar un soluto a un solvente, tanto las moléculas de soluto como de solvente se encuentran ordenadas y unidas entre sí mediante interacciones intermolecuales. Cuando agregamos el soluto al solvente ocurre una disminución de estas interacciones soluto-soluto y solvente-solvente, dando lugar a una expansión de estos enlaces que permite que se intercambien lugares entre las moléculas y se produzca un reordenamiento.
La solvatación exige un gasto de energía que se emplea en la ruptura de los enlaces que mantienen unidos los iones o moléculas del soluto, así como la propias moléculas del solvente, por lo que en un principio este proceso es endotérmico, aunque luego se produce una liberación de energía cuando se establecen las interacciones soluto-solvente, produciéndose también una fase exotérmica.
Disolución, solvatación e hidratación
La disolución es el proceso empleado para formar una solución, una mezcla homogénea, bien sea disolviendo un soluto en un solvente o añadiendo más solvente a una solución ya preparada, en cualquier caso, este proceso implica la dispersión de cada molécula o ion del soluto en el solvente, ahora bien, la solvatación es la formación de interacciones entre cada molécula o ion del soluto con el solvente en el seno de la disolución, lo que lleva a la estabilización de la misma para que las moléculas de soluto no se vuelvan a unir. Es decir, la solvatación es lo determina que sucede entre las moléculas de soluto y solvente en una disolución.
Por otro lado, cuando el solvente es el agua, por lo general la solvatación suele denominarse hidratación. Cuando una molécula o ion de soluto se rodea de moléculas de agua, los átomos de oxígeno de la molécula de agua se orientan hacia al ion positivo o a la parte positiva de la molécula de soluto formando interacciones ion-dipolo, pero estas moléculas de agua también pueden formar enlaces de coordinación con el ion o molécula central, formando acuocomplejos.

Cuando el sufato cúprico se disuelve en agua el ión cobre se rodea de cuatro ligandos acuo. Fuente: @emiliomoron.
Ejemplos y usos de la solvatación
La Urea es una molécula orgánica de formula CH4N2O. Cuando agregamos urea en agua, las moléculas de agua rodean las moléculas de Urea debido la posibilidad de formar puentes de hidrogeno con los grupos aminos y carbonilos presentes en la estructura de la urea.
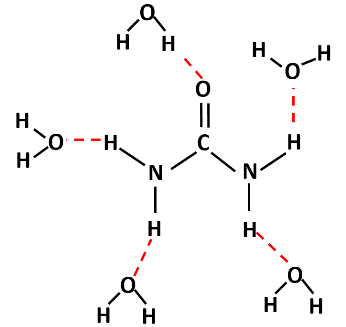
La molécula de urea forma puentes de hidrogeno con las moléculas de agua que le rodean. Fuente: @emiliomoron.
Debido a la fuerte polaridad de la molécula de urea y posibilidad de establecer estos enlaces, la urea es muy soluble en agua, por lo que pasa rápidamente a un estado más desordenado en el seno del solvente, adsorbiendo energía en el proceso, bajando la temperatura de la solución, lo que se ha empleado en la elaboración de bolsas para enfriar rápidamente bebidas.
Bueno amigos, espero que les haya gustado la información sobre el proceso de solvatación y sus usos. ¡Hasta la próxima!
Referencias
James G. Speight (2020). Water chemistry. Natural Water Remediation, Pages 91-129
Wikipedia.com. Solvatación
Wikipedia.com. Cloruro de calico
Wikipedia.com. Urea
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
¡Enhorabuena!
✅ Has hecho un buen trabajo, por lo cual tu publicación ha sido valorada y ha recibido el apoyo de parte de CHESS BROTHERS ♔ 💪
♟ Te invitamos a usar nuestra etiqueta #chessbrothers y a que aprendas más sobre nosotros.
♟♟ También puedes contactarnos en nuestro servidor de Discord y promocionar allí tus publicaciones.
♟♟♟ Considera unirte a nuestro trail de curación para que trabajemos en equipo y recibas recompensas automáticamente.
♞♟ Echa un vistazo a nuestra cuenta @chessbrotherspro para que te informes sobre el proceso de curación llevado a diario por nuestro equipo.
Cordialmente
El equipo de CHESS BROTHERS
Muchas gracias!
Η ανάγνωση για endothermic reactions και solvatation είναι εξαντλητική! Με κουράζει το να προσπαθώ να καταλάβω την χημεία της διαλύσεως. Εγώ χρειαζόμουν μια αλλαγή που να ήταν άμεση και να έχει μηδενική χημική ανάλυση. Ένας φίλος μού σύστησε το https://chickenroad.net.gr και με ενθουσίασαν οι εξαιρετικές προσφορές για την Ελλάδα. Δοκίμασα το 'Roulette'—είχα συνεχείς απώλειες, αλλά ρίσκαρα λίγο περισσότερο και πέτυχα ένα απίστευτο κέρδος.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Gracias por el apoyo amigos!