Regla de la palanca en diagramas de fases de sistemas binarios
Los diagramas de fases T vs x y P vs x son bastante útiles tanto en química como muchas ramas de la ingeniería, ya que nos permiten conocer de forma gráfica, y muy fácil de entender, información sobre las diferentes fases que se encuentran en equilibrio. No solo permiten tener una visión general del comportamiento del sistema, sino que permite extraer información cuantitativa de la composición y la cantidad de cada una de las fases presentes. Para una mezcla binaria, la dificultad de extraer información aumenta con el número de fases, sin embargo existe un método muy sencillo utilizado para conocer la proporción en la que se separan dos fases de una mezcla binaria cuando se somete a una determinada temperatura o presión dada; y este método se conoce como la regla de la palanca.
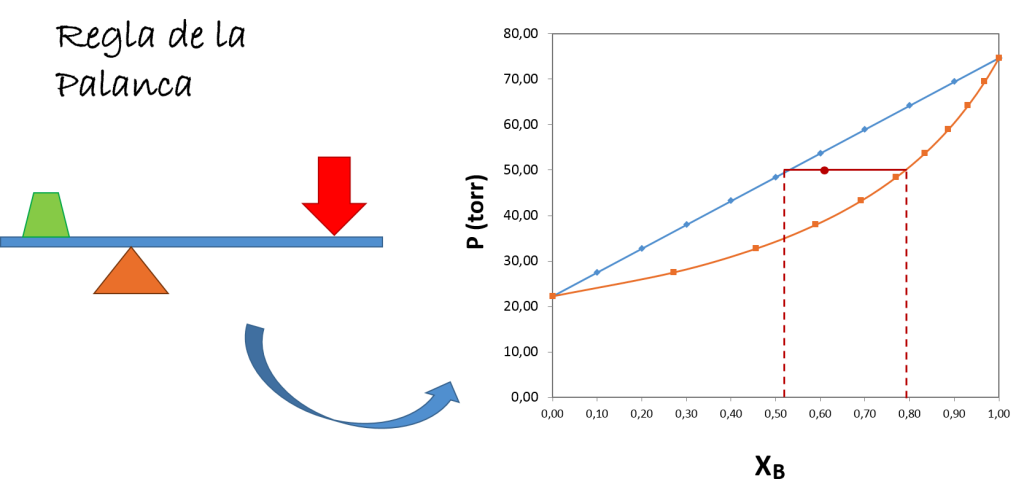
En los diagramas de fases es aplicable la herramienta conocida como regla de la palanca. Fuente: @emiliomoron.
Esta regla es aplicable en sistemas bifásicos, sin importar si las dos fases en equilibrio son sólidas, con el caso de las aleaciones, o un líquido y un gas, como sucede con la destilación de componentes volátiles. Pongamos un ejemplo, cuando se mezclan dos líquidos completamente miscibles, como el metanol y el agua, se forma una mezcla líquida homogénea, y si a la presión de 1 atmósfera comenzamos a destilar mezclas con diferentes proporciones de estos líquidos, nos encontraremos con un diagrama de fases como el que se muestra a continuación.
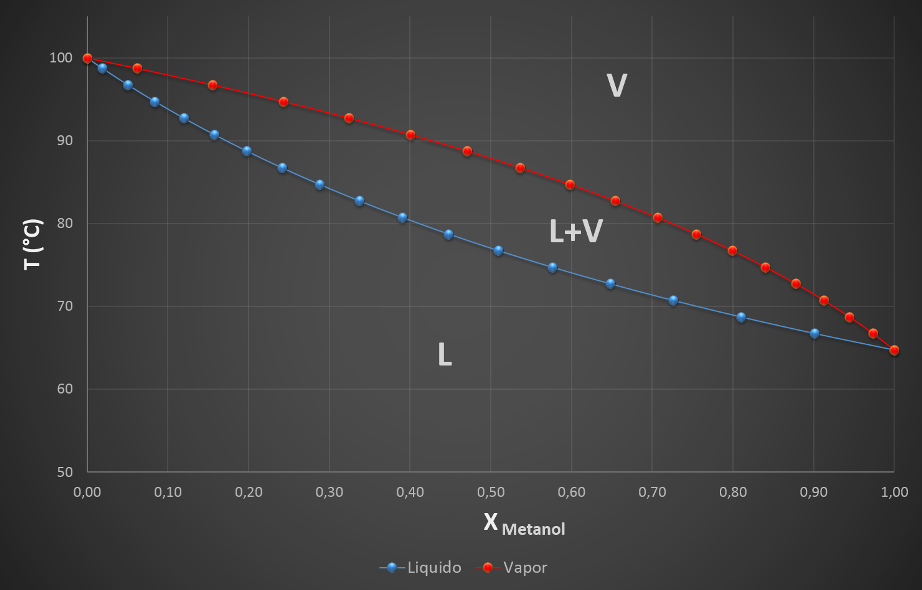
Diagrama de equilibrio líquido-vapor para el sistema metanol-agua a presión atmosférica. Fuente: @emiliomoron.
En el diagrama podemos observar gráficamente la formación de tres regiones, muy por debajo de la temperatura de ebullición de los líquidos (pero por encima de su punto de congelación) tenemos una región en la que cualquier mezcla permanece en fase líquida, si en caso contrario calentemos el sistema por encima del punto de ebullición de ambos líquidos todo el sistema pasará a la fase vapor. Pero a ciertas temperaturas intermedias entre ambos puntos de ebullición, una determinada cantidad de la mezcla líquida vaporizará, permaneciendo en equilibrio una fase líquida y una fase vapor, formando así una región bifásica.
Digamos que se desea determinar la cantidad de líquido o vapor que se forma cuando una mezcla de composición m = 0,3 se calienta hasta 90 °C. Para ello entonces procedemos a trazar una trazar una isoterma (línea horizontal) que atraviese la región bifásica a la temperatura deseada, conectando la curva de condensación (líquido) y la curva de vaporización (gas), originando los puntos a y b. A esta línea que une los puntos a, m y b se le conoce como línea de unión.
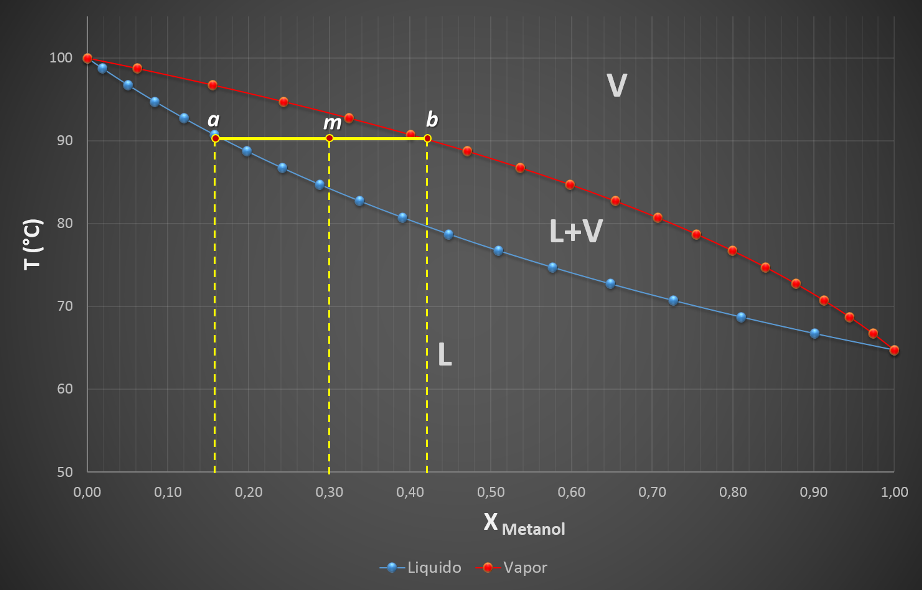
La línea de unión conecta las composiciones de dos fases en equilibrio. Fuente: @emiliomoron.
Las líneas perpendiculares a la línea de unión, que se prolongan hasta el eje x, determinan las composiciones de ambas fases. La línea que se extiende desde a hasta el eje x determina la composición de la fase líquida, xmL; mientras que la línea que se extiende desde b determina la composición del vapor, xmV.
Así como en los brazos de una palanca se balancean cargas, la regla de la palanca en los diagramas de fase se sustenta en que los moles de las fases conectadas por la línea de unión también deben estar en equilibrio, en una proporción definida por las distancias entre a-m y m-b.
Veamos cómo. Tenemos que la fracción molar de la mezcla en el punto m viene dada por:
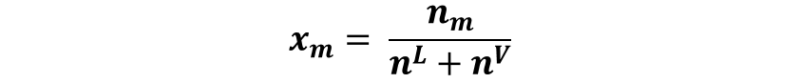
Donde nm corresponde a los moles de metanol, nL y nV representan los moles de metanol en la fase líquida y vapor respectivamente. Si despejamos nm nos quedaría como:
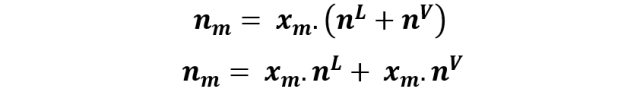
Pero,
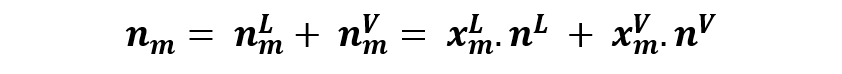
Por tanto se puede escribir que:
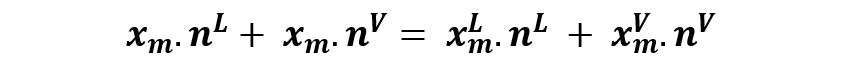
Y al reordenar la expresión nos queda que:
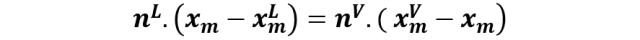
Notemos ahora que xm - xm L es la distancia entre m y a; y que xmV - xm es la distancia entre m y b. Lo que es la ecuación de la regla de la palanca.
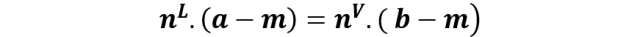
Volvamos al diagrama de fases del sistema metanol-agua y supongamos que se quiere saber la cantidad de vapor formado al calentar una mezcla compuesta de 3 moles de metanol y 10 moles de agua a 90 °C. Entonces, la fracción molar de la mezcla equivale a:
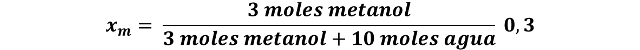
Esta fracción molar a 90 ° C corresponde al punto m en el diagrama, por lo que podemos leer las composiciones de las fases formadas en las rectas perpendiculares a la línea de unión.
Y ahora usaremos la regla de la palanca.
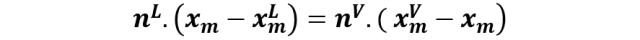
Y sabiendo que los moles totales es la sumatoria de los moles en la fase líquida y los moles en la fase vapor, y que en total hay 13 moles en la mezcla, podemos despejar nV de la siguiente forma:
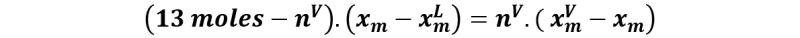
Y ahora reordenamos y despejamos nV.
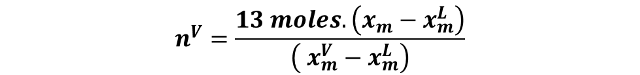
Y al sustituir se obtiene:
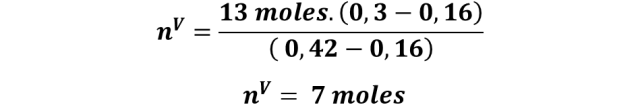
Es decir, que de los 13 moles iniciales, al calentar la mezcla se obtendrán 7 moles de fase vapor, con una fracción molar de 0,42 en metanol. Por lo que la regla de la palanca constituye una herramienta gráfica de mucha ayuda para determinar la cantidad de las fases formadas en un sistema binario, y la composición de estas fases; algo que es muy importante para comprender las operaciones unitarias de separación.
Bueno amigos, espero les haya gustado la información sobre la aplicación de la regla de la palanca en los diagramas de fase binarios. ¡Hasta la próxima!
El diagrama de fases del sistema metanol-agua fue elaborado en excel, utilizando la ecuación de Antoine, tomando los parámetros de la ecuación de las tablas de constantes del libro de termodinámica Smith Van Ness, 8va edición.
Referencias
Libretexts. La regla de la palanca.
Wikipedia.com. Regla de la palanca
Levine, I. (2004). Fisicoquímica. 5ta edición. McGrawHill
Hola mi estimado amigo @emiliomoron, que bueno que me tope con este post, ya que nunca había escuchado sobre esta regla de la palanca para ser aplicado en la química. Saludos y gracias por tu aporte.
Hola amigo @carlos84, me alegra que pasaras a leer el post y que encontraras información interesante, saludos!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Felicitaciones!
1. Invierte en el PROYECTO ENTROPÍA y recibe ganancias semanalmente. Entra aquí para más información.
3. Suscríbete a nuestra COMUNIDAD, apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
4. Creación de cuentas nuevas de Hive aquí.
5. Visita nuestro canal de Youtube.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA