Reciclando una pila salina
En nuestro hogar tenemos una gran cantidad de aparatos que funcionan con pilas, basta con enumerar los juguetes de nuestros niños o los controles remoto de los equipos de audio y video. Así que tenemos clara la importancia de este pequeño dispositivo en nuestra vida diaria, pero, ¿sabes lo que hay dentro y cómo funciona? De seguro en alguna oportunidad habrán examinado que hay dentro de una pila, ¿no, o solo he sido yo? Bueno si no lo han hecho quédense a leer para mostrarles que contiene y que hace que funcionen, aprovechando que hice el despiece de una pila triple A para reutilizar algunas partes.

Pila de zinc-carbono triple A. Fuente: @emiliomoron.
Empecemos por establecer que es una pila y cuáles son sus componentes
El tipo de pila común, la de zinc-carbono, también conocidas como pila seca o salina; es un dispositivo que funciona como una celda electroquímica, de la cual obtenemos energía eléctrica a partir de una reacción química entre dos compuestos, el zinc y el dióxido de manganeso. Este dispositivo está conformada por un recipiente externo de zinc, que hace las veces tanto de contenedor como de ánodo (o terminal negativo), en su interior se encuentra el catado (o terminal positivo) formado por dióxido de manganeso (MnO2) y carbón, y el electrolito, una mezcla de cloruro de amonio y cloruro de zinc en pasta[1]. El electrolito se separa del dióxido de manganeso mediante un separador de papel, y el carbón en la mezcla ayuda a su compactación y mejorar la conductividad.
En el interior también se encuentra una barra de grafito, que además de ser un electro colector de la corriente, proporciona soporte a la pila; y gracias a su porosidad, el hidrogeno producto de las reacciones químicas implicadas puede escapar del dispositivo. El recubrimiento cilíndrico de zinc tiene una placa metálica en su base que sirve de contacto negativo, y del mismo modo, sobre el electrodo de grafito se coloca otra placa para hacer de contacto positivo. La envoltura plástica no solo se usa para timbrar la marca del fabricante sino que también proporciona protección al contenedor de zinc. En la siguiente imagen podemos observar una representación de las partes mencionadas.
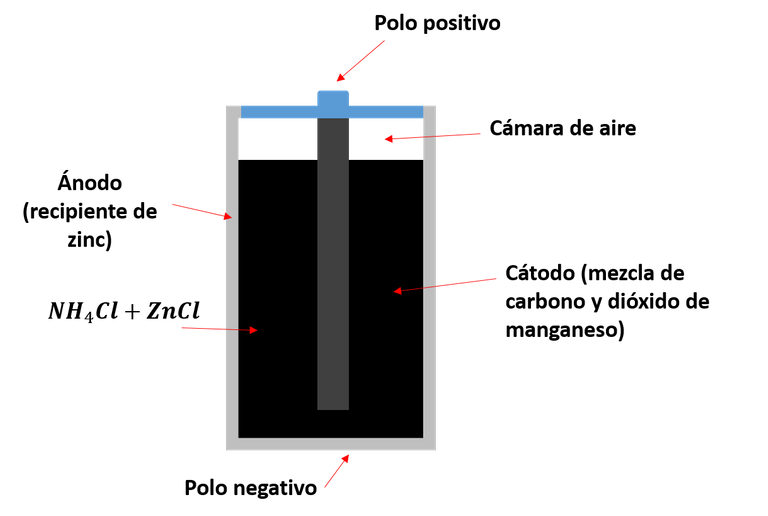
Representación de las partes de una pila de zinc-carbono. Fuente: @emiliomoron.
Reacciones químicas que se producen
Veamos que ocurre cuando se pone en funcionamiento una pila de zinc-carbón.
Como mencionamos anteriormente, el recipiente de zinc funciona como contenedor y como ánodo de la pila, en este tiene lugar una reacción de oxidación del zinc:
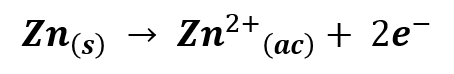
En la reacción, el zinc pierde dos electrones y se oxida a su estado de oxidación +2, mientras que los electrones liberados viajan a través del circuito hasta llegar a la barra de grafito, donde tiene lugar la reacción de reducción del óxido de manganeso:
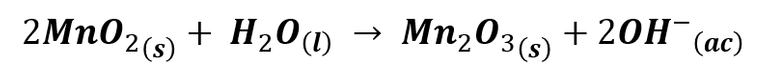
En esta reacción, el manganeso se reduce de su estado de oxidación +4 a +3.
Por otro lado, a partir del electrolito, el cloruro de amonio da lugar a iones cloruro al reaccionar con los iones hidronio.
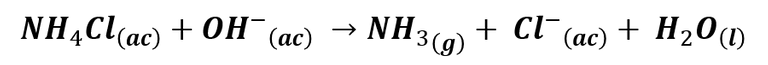
Cuando se combinan las reacciones anteriores se obtiene:
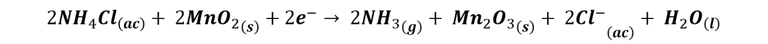
Pero además, en el electrodo de grafito también se produce la reducción del cloruro de amonio:
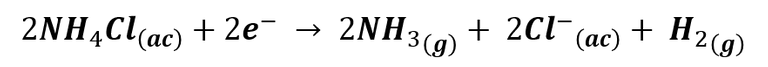
El resultado de estas reacciones es la polarización de la pila; cargándose positivamente en el entorno del electrodo de zinc debido a la producción de iones Zn2+, mientras que en el entorno de la barra de grafito se carga negativamente, gracias a la producción de iones Cl-, generando en el dispositivo una diferencia de potencial entre 1,4 y 1,6 v.
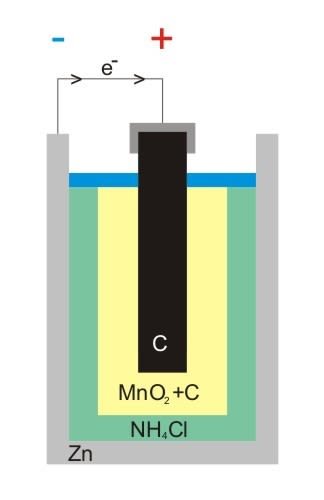
Esquema de la polarización de una pila. Fuente: Wikipedia.com, imagen de dominio público.
Despiece de la pila salina
Una vez que conocemos el funcionamiento de la pila podemos pasar a desarmarla sabiendo que precaución debemos tomar al hacerlo. Aunque si bien no hay un compuesto en exceso peligroso, nos conviene al menos utilizar guantes y lentes de seguridad.
Como sabemos hay pilas de diferentes tamaños, yo he tomado una triple A. Primeramente retire el plástico que protege el contenedor de zinc, esta envoltura ayuda a prevenir el deterioro de la pila y sostiene la placa de metal que funciona como terminal negativo.

Retiro de cubierta plástica de la pila. Fuente: @emiliomoron.
Luego, con ayuda de un destornillador retire la placa metálica que sirve de contacto positivo. Como se observa en la imagen, al retirar esta placa ya queda parcialmente descubierto el electrodo de grafito. También se observa un anillo plástico que sirve para sellar el contenedor.

Vista de la pila al retirar el contacto positivo. Fuente: @emiliomoron.
Al retirar este anillo platico continúe con el corte del contenedor de zinc con ayuda de una pinza, lo fui haciendo de forma vertical para ir descubriendo todos los componentes de la pila. En la siguiente imagen los podemos observar.

Vista de la separación entre la mezcla con dióxido de maganeso y el contacto positivo de la pila. Fuente: @emiliomoron.
Se puede visualizar que luego del anillo de plástico sigue una cubierta de resina color negro y posteriormente un par de arandelas de cartón separadas por un espacio, la última de estas sella y separa el contenido del recipiente de zinc y la punta del electrodo. Al retirar la arandela ya se puede observar una pasta de color negro, esta constituye la mezcla de óxido de manganeso, electrolito y carbón. Al empezar a cortar el contenedor de zinc se observa el papel poroso y tras este, esta la pasta (o polvo, dependerá de la cantidad de agua que haya absorbido), una vez abierto todo el recipiente es muy fácil extraer el electrodo de grafito y la mezcla de color negro.
En la siguiente imagen podemos apreciar todas las partes mencionadas.

Identificación de los componentes de una pila de zinc-carbono. Fuente: @emiliomoron.
Partes aprovechables de la pila
Bueno, hicimos esto porque como les mencioné pienso utilizar algunas partes de la pila. Lo primero que tengo en mente es utilizar el electrodo de grafito para construir una celda electroquímica; ya que este es un buen conductor y es inerte, es ideal para realizar experimentos de electrolisis (pronto verán alguno). Para ello conviene raspar un poco su superficie, lavarlo muy bien y dejarlo secar, así ya estará listo para unirlo a un cable conductor y reutilizarlo como electrodo.
El zinc es un elemento que reacciona muy bien con ácidos, y tiene buenas propiedades redox, ya lo utilice antes para hacer una electrodeposición de zinc sobre cobre, así que me servirá para otros experimentos de óxido-reducción. Po ello lo limpié muy bien y conserve tal cual.

Partes aprovechables de la pila, de izquierda a derecha: mezcla de dióxido de manganeso, electrodo de grafito y cubierta de zinc. Fuente: @emiliomoron.
Para la mezcla que contiene el dióxido de manganeso, carbón y electrolito aún no tengo establecida una forma de aprovechamiento, pero para no desecharla todavía la conservaré mientras investigo.
Aportes
Con el post espero haberles traído información que resultara de su interés respecto a la composición y funcionamiento de una pila de zinc-carbón. Al relacionar las partes con el funcionamiento de la misma provee una guía para el abordaje didáctico de temas como reacciones de óxido-reducción, que sustancias se comportan como electrolitos, y funcionamiento de una celda electroquímica. Destacando así el aprovechamiento de elementos cotidianos para la realización de experiencias prácticas en casa, como una forma de acercar más la química a los estudiantes, estimulando así su observación y análisis de procesos químicos que ocurren a su alrededor. Y por otro lado, Además, sirve de apoyo para una serie de post en los que emplearé las partes mencionadas.
**_Bueno amigos, es todo por los momentos, espero que la información les sea útil, muchas gracias por leer el post. ¡Hasta el próximo!_**
Referencias
- Wikipedia.com. Zinc-carbon battery.
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Excelente explicación sobre el interior de una batería y las reacciones químicas que se presentan.
Por curiosidad, una pila genera o almacena energía? química o eléctrica?
Nos servirá de información complementaria mi estimado @emiliomoron
Saludos amigo @iamphysical. Una pila puede considerarse un generador de energía, convierte la energía química almacenada en energía eléctrica. Quizásluego pueda hacer un post para completar la información. Gracias por pasar a leer y dejar tu comentario.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Muchas gracias por el apoyo amigos!
Saludos estimado amigo @emiliomoron, excelente entrega.
Considero que el elemento de mayor relevancia al subir contenido a la plataforma HIVE, es socializar el enfoque práctico de la información, partiendo del hecho que la diversidad de usuarios que coexisten en HIVE en su mayoría no tienen interés en el contenido STEM. Por lo que, al esquematizar en nuestros manuscritos el elemento de utilidad práctica, el post puede ser del agrado y utilidad de un mayor número de usuarios.
Cuando manifiestas que utilizarás el electrodo de grafito para construir una celda electroquímica, además de crear la expectativa, generas cierta curiosidad y al mismo tiempo invitas a leer en la búsqueda de otras aplicaciones. Felicitaciones, como de costumbre buen post.
Saludos amigo @lupafilotaxia. Ciertamente cuando subimos un contenido STEM al que el lector puede asociar su utilidad resulta de mayor agrado, y tiene la posibilidad de llegar a más usuarios que un contenido de teórico muy especializado, y más cuando son elementos tan cotidianos como una pila. Me alegra que el post genere la expectativa sobre la utilidad de los elementos aprovechados, así habrá más curiosidad por leer el próximo y como dices hacer su propia búsqueda de información. Muchas gracias a ti por pasar a leer y dejar tu impresión.
Bastante explicativo el contenido y funcionamiento de la pila, un objeto que utilizamos cotidianamente sin saber exactamente cómo funciona. Tengo entendido que las pilas deben reciclarse a parte de la basura normal en caso de ser desechadas debido a su contenido químico, y reciclarlas para utilizarlas en alguna otra aplicación sería más amigable con la naturaleza, es por ello que este contenido es de gran utilidad para estimular el aprovechamiento de este tipo de dispositivos más allá de su vida útil. Gracias por compartir, saludos @emiliomoron.
Saludos amigo @acont. Ciertamente las pilas y baterías son fundamentales para el funcionamiento de múltiples aparatos que nos hacen la vida más cómoda y muchos desconocemos su funcionamiento, eso es otra cosa que influye para su adecuada disposición cuando estan agotadas, ya que estas pueden contener metales como zinc, cadmio, litio o plomo que resultan metales peligrosos para el ambiente, además pueden contener sustancias alcalinas o ácidas nocivas para suelos y aguas constituyendo peligrosos vertidos; por eso no se deben desechar junto a la basura doméstica. Y bueno, un aprovechamiento de estos materiales supone una reducción de la extracción de los minerales vírgenes usados en su fabricación y una disminución del impacto ambiental que pueden generar, lo que sin duda es un beneficio para el ambiente. Gracias a ti por pasar a leer mi estimado.