Reacciones REDOX de sulfato cúprico con varios metales
Como sabemos, en toda reacción química se produce una interacción entre las especies que constituyen los reactivos para dar origen a los productos, hay muchas formas en la que estas especies pueden interactuar, bien sea descomponiéndose, combinándose, desplazando unas a otras en otros compuestos, y entre este conjunto de formas interacción, las denominadas reacciones de oxidación-reducción, también llamadas REDOX son muy importantes en la química.
Una reacción REDOX se produce por un intercambio de electrones, uno de los reactivos cede o pierde electrones y el otro reactivo los acepta o recibe; en este proceso, el reactivo que pierde los electrones es quien se oxida y el que los recibe se dice que se reduce. Para ilustrar este tipo de reacciones químicas vamos a ver en este post algunos experimentos de óxido-reducción entre el sulfato cúprico (CuSO4) y varios metales.

Analicemos las reacciones REDOX. Fuente: @emiliomoron.
Comprender este tipo de reacciones es muy importante ya que nos proporcionan el fundamento para la obtención de electricidad mediante las baterías y también el principio de recubrimiento de superficies metálicas con otros metales que se encuentran en solución.
Sulfato cúprico
El sulfato cúprico o también sulfato de cobre (II), de formula química CuSO4 en su forma anhidra, es un compuesto muy empleado en la industria química, se emplea en la agricultura como pesticida, también tiene aplicación en el tratamiento de aguas como alguicida; la forma más común de encontrar este compuesto es en su forma pentahidratada, CuSO4x5H2O, la cual en su forma de sal cristalizada es de color azul, por eso nos proporciona soluciones de este color, y en solución, se utiliza como electrolito que produce cationes multivalentes: Cu2+ por ello es muy utilizada en la industria de los recubrimientos metálicos por vía electrolítica.

Sulfato cúprico pentahidratado (izquierda) y sulfato cúprico anhidro (derecha). Fuente: @emiliomoron.
Experimentos
Para demostrar el concepto de intercambio de electrones que se lleva a cabo en las reacciones REDOX, vamos a poner los metales aluminio, hierro y zinc en contacto directo con una solución de sulfato cúprico. Como ya veremos, los metales que vamos a emplear son menos nobles que el cobre según sus potenciales de reducción, es por ello que veremos que los iones Cu2+ en solución se transforman en cobre metálico a costa de oxidar los metales menos nobles que él que entren en la solución.

Materiales a emplear en el experimento. Fuente: @emiliomoron.
Reacción entre sulfato cúprico y aluminio
Entonces, en este primer experimento vamos a sumergir una lámina de aluminio en una solución de sulfato cúprico.

Inicio del experimento. Fuente: @emiliomoron.
Luego de sumergir la lámina en la solución vamos a observar un burbujeo y la deposición de un sólido rojizo sobre la lámina.

Progreso del experimento. Fuente: @emiliomoron.
El deposito rojizo que observamos se debe a la oxidación del aluminio metálico a iones Al3+ y a la reducción de los iones Cu2+ a cobre metálico.

Resultado del experimento. Fuente: @emiliomoron.
La deposición de cobre sobre la lámina de aluminio se debe a las siguientes semireacciones:
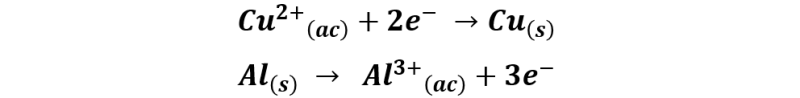
La reacción global se puede representar como:

Es por ello que al instante de sumergir la lámina de aluminio en la solución de sulfato cúprico vemos la formación de una capa rojiza sobre la lámina, lo cual corresponde al cobre reducido depositándose sobre el aluminio, mientras que iones aluminio son transferidos a la solución producto de la perdida de electrones.
Por otro lado el burbujeo se debe al desprendimiento de hidrogeno según la reacción:

Reacción entre sulfato cúprico y hierro
Veamos cómo se representa esta situación pero al introducir un clavo de hierro en la solución de sulfato cúprico.

Inicio del experimento. Fuente: @emiliomoron.
De forma similar al caso anterior, al introducir el clavo de hierro en la solución notaremos que en pocos instantes comienza a recubrirse con una capa rojiza, nuevamente se trata del cobre reducido depositándose sobre el hierro.

Progreso del experimento. Fuente: @emiliomoron.
El proceso se describe mediante las siguientes reacciones:
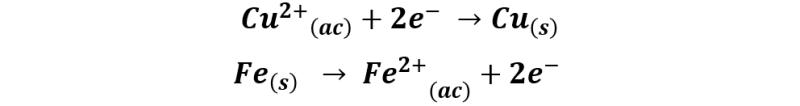
La reacción global quedaría representada de la siguiente forma:

En la siguiente imagen podemos observar la deposición del cobre sobre la parte sumergida del clavo.

Resultado del experimento. Fuente: @emiliomoron.
Reacción entre sulfato cúprico y Zinc
Procederemos de la misma forma ahora sumergiendo en la solución una lámina de zinc que he extraído de una pila gastada.

Inicio del experimento. Fuente: @emiliomoron.
En este caso notaremos que con apenas segundos de haber sumergido la lámina de zinc en la solución esta va adquiriendo un recubrimiento de color negro, igualmente se trata de cobre metálico que al ser reducido por la aceptación de electrones se deposita sobre el zinc, solo que en este caso la deposición es muy rápida y el cobre no cristaliza adecuadamente con ese característico color rojizo.

Progreso del experimento. Fuente: @emiliomoron.
Por su lado, el zinc que pierde dos electrones y pasa a la solución en forma de iones zinc. El proceso se describe según las siguientes semireacciones:
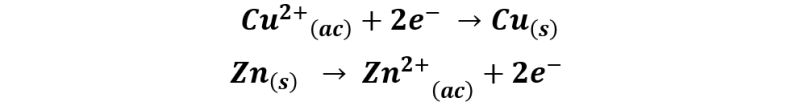
La reacción global quedaría de la forma siguiente:
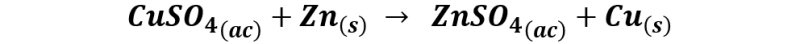
En la siguiente imagen podemos observar el resultado de la deposición de cobre sobre la lámina de zinc.

Resultado del experimento. Fuente: @emiliomoron.
Y en la siguiente imagen podemos comparar como se ha depositado el cobre, debido a su reducción a cobre metálico, en los tres metales empleados para el experimento.

Resultado de la reacción REDOX entre sulfato cúprico y los metales empleados en el experimento. Fuente: @emiliomoron.
Como vemos, es fácil interpretar una reacción química cuando va acompañada de una experiencia demostrativa, en este caso, es fácil visualizar como el cobre que se encuentra en forma de iones en la solución es capaz de depositarse sobre elementos metálicos menos nobles como el zinc o el hierro, y con ello podemos demostrar cómo se produce se produce este efecto debido a la transferencia de electrones en lo que constituye una reacción REDOX.
Bueno amigos espero haber compartido información de interés sobre este importante tipo de reacción química. ¡Hasta la próxima!
Referencias
Wikipedia.com. Reducción-oxidación.
Atkins, P., Jones, L. (2006). Principios de química. 3a edición, Médica Panamerica, Buenos Aires.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more
Saludos @emiliomoron
De ante mano gracias por tan interesante lectura, es muy bonito ver como la química siendo considerada una ciencia abstracta tiene múltiples de aplicaciones en la vida diaria.