¿Qué es un patrón primario?
En química utilizamos la valoración de soluciones para determinar la concentración precisa de una solución que se utilizara como reactivo en una reacción. Ustedes se preguntaran, por qué debemos precisar la concentración de una solución haciéndola reaccionar con otra sustancia, la respuesta es simple, si quisiéramos preparar una solución de hidróxido de sodio (NaOH) no es suficiente solamente pesar la cantidad de hidróxido de sodio y disolverlo en un volumen adecuado de agua, ya que este compuesto absorbe humedad y CO2 del ambiente, entonces, cuando tomamos una muestra de 1 g de NaOH también contiene agua y CO2, por lo que la cantidad de NaOH sólido es un poco menor y eso afecta la concentración real de la solución.

La estandarización con un patrón primario siempre es necesaria. Fuente: @emiliomoron.
Por eso, para verificar la concentración real que ha resultado al disolver una cantidad de NaOH en agua destilada, se procede a la valoración o estandarización de la solución con otra sustancia, en este caso con ftalato ácido de potasio (KHC8H4O4), ya que este reactivo ni absorbe agua ni CO2, por lo que tendremos una confirmación de la cantidad real de NaOH pesado.
Patrón primario
Son compuestos de alta pureza que sirven de referencia en todos los métodos volumétricos p gravimétricos[1]. Compuestos como el ftalato ácido de potasio, que no absorben agua ni otras sustancias presentes en la atmosfera mantienen su pureza, por lo que pueden ser utilizados para calibrar soluciones de otras sustancias mediante el proceso de titulación; la cual consiste en colocar el patrón primario en la bureta y haciéndolo reaccionar lentamente con la solución a estandarizar colocada en un Erlenmeyer. Un indicador en la solución a estandarizar indica el punto final de la titulación.

Ejemplo de una titulación. Fuente: @emiliomoron.
Así, la solución utilizada en la bureta como titulante es el patrón primario y la solución estandarizada de esta forma recibe el nombre de patrón secundario.
Propiedades
Para ser utilizado como patrón primario, un compuesto debe cumplir una serie de requisitos[1]:
- Pureza elevada, son reactivos cuya pureza es de aproximadamente 99,9%.
- Estabilidad atmosférica. Durante su almacenamiento, muchas sustancias reaccionan con compuestos presentes en el aire, como dioxdido de carbono y oxígeno, lo que altera su composición.
- Ausencia de agua de hidratación, así la composición del sólido no cambiara con las variaciones de humedad relativa en el ambiente.
- Debe tener una masa molar relativamente grande, así se reduce al mínimo el error relativo asociado al proceso de pesada.
- Entre otras características se pueden mencionar que deben ser económicas, disponible, y preferiblemente poco tóxicas.
Ejemplos de patrones primarios
Dependiendo el tipo de titulación utilizada se pueden encontrar patrones para:
Estandarizar bases
Como ya mencionamos antes, el ftalato ácido de potasio se utiliza para estandarizar soluciones básicas de hidróxido de sodio, la reacción de titulación puede escribirse como:
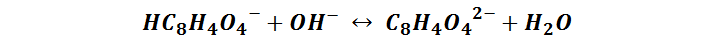
Otras sustancias utilizadas como patrones primarios de bases son: sal doble de ácido sulfosalicílico, ácido sulfanílico, ácido benzoico y ácido oxálico.
Estandarizar ácidos
Para una solución ácida se pueden utilizar soluciones de carbonato de sodio, Na2CO3. La reacción de titulación se puede representar de la siguiente forma:

Otros compuestos que se pueden utilizar son: tris(hidroximetil)aminometano y bórax.
Reacciones redox
Para las estandarizaciones redox se pueden emplear varios reactivos como patrones primarios, dependerá de la sustancia a estandarizar. El oxalato de sodio se utiliza para estandarizar soluciones de permanganato de potasio, el trióxido de arsénico se utiliza en titulaciones de yodo (I2), soluciones de ion Fe+2 se utilizan como patrón primario para valorar soluciones de sulfato de cerio y dicromato de potasio, y el cobre se utiliza como patrón para el tiosulfato de sodio.
La reacción de estandarización del permanganato de potasio en medio ácido con ácido oxálico se puede representar como:
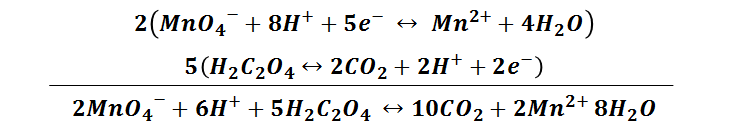
Reacciones con formación de complejos
El EDTA es uno de los compuestos con fines analítos es esta sal disodica, ya que forma complejos con iones metálicos con facilidad, por lo que es muy utilizados en su determinación en muestras de agua, por ejemplo el EDTA se utiliza para la determinación de magnesio y calcio y determinar la dureza del agua.
Pero las soluciones de EDTA no son lo suficientemente puras por lo que antes de ser utilizada, se deben titular con carbonato de calcio, el cual actúa como patrón primario.
Para la titulación del EDTA se solubiliza el carbonato de calcio en HCl:
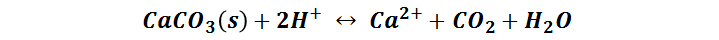
Y la reacción de titulación procede según la ecuación:
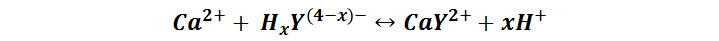
Preparación de soluciones patrón
 Fuente: @emiliomoron
Fuente: @emiliomoronPara preparar una solución de patrón primario se pesa cuidadosamente en balanza analítica una cantidad del compuesto a utilizar, y se disuelve en el volumen de disolvente apropiado necesario, utilizando un matraz aforado.
Su concentración molar se expresa como:
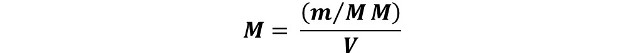
donde: m es la masa delpatrón primario, MM su masa molar y V el volumen.
A veces es necesario preparar una serie de estándares, cada uno con una concentración diferente del analito. Para ello se puede proceder de dos maneras. Si el rango de concentraciones se limita a uno o dos órdenes de magnitud, la mejor manera de preparar cada solución es transfiriendo una masa conocida del patrón puro a un matraz aforado y diluyendo hasta el volumen apropiado. Pero si se va a trabajar con rangos de concentración más amplios, la mejor forma de preparar el patrón primario es mediante una dilución en serie a partir de una única solución madre.
Bueno amigos, como ven, hay varios factores a considerar en cuanto a la elección del patron primario se refiere, algo muy importante a tener en cuenta cuando se va a realizar la estandarizacion de una solución, un procedimiento que es frecuente en cualquier laboratorio químico.
Gracias por pasar a leer, espero que la información les sea de utilidad, ¡hasta la próxima!
Referencias
Douglas, Skoog; Donald, West; F. James, Holler; Stanley R., Crouch (2001). Química analítica. 7ma edición.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
¡Felicidades! Esta publicación obtuvo upvote y fue compartido por @la-colmena, un proyecto de Curación Manual para la comunidad hispana de Hive que cuenta con el respaldo de @curie.
Si te gusta el trabajo que hacemos, te invitamos a darle tu voto a este comentario y a votar como testigo por Curie.
Si quieres saber más sobre nuestro proyecto, acompáñanos en Discord: La Colmena.
Gracias @la-colmena!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Gracias por el apoyo amigos!