Pátina de cobre, la ciencia de cómo se forma
Pues bien, esta pátina es una capa de sales de cobre que se produce por el proceso de corrosión que experimenta este metal, ya que, como otros metales, el cobre se oxida por la tendencia natural que tiene a retornar a su estado mineral; es decir, en forma de óxido. Así que, al estar expuestos al ambiente lentamente se combinan con algunos elementos que se encuentran en el aire para volver a su estado natural. La particularidad del cobre, es que esta pátina formada por el proceso de corrosión, luego lo protege del mismo, impidiendo que el metal se deteriore con el paso del tiempo, haciendo perdurable nuestros patrimonios y a la vez dotándolos de una elegante belleza, ya que esta pátina va cambiando de color con el tiempo y es única para cada lugar debido a sus diferentes condiciones climáticas, por eso la belleza del cobre y sus aleaciones es única entre los metales decorativos.

Contraste entre el color del cobre pulido y la pátina. Fuente: @emiliomoron.
Así, aunque el cobre no se mantiene como un metal brillante, si es un metal que se adorna de una hermosa pátina que incluso puede contar su historia. Saber cómo se forma esta capa protectora les dará otra visión de los cambios que ocurren a lo largo de la historia de nuestros monumentos o algún recuerdo familiar. Por eso, en este post quiero comentar como el proceso de corrosión natural del cobre nos brinda esta colorida pátina.
¿Cómo se forma esta pátina verde sobre el cobre?
La formación de la pátina de cobre es muy similar a la formación del óxido de hierro, ambas ocurre producto de la interacción de los átomos del metal con el oxígeno del aire en presencia de agua.
El cobre reacciona con el aire formando dióxido de cobre (reacción 1), el cual luego reacciona con más oxígeno para formar óxido de cobre (reacción 2).
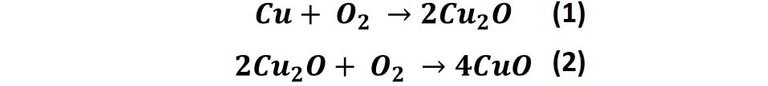
Este óxido de cobre formado en la reacción 2 es el responsable de que más tarde se formen los colores de la pátina. Ya que en el aire que respiramos hay más que oxígeno, las reacciones del cobre no se limitan a estas dos. Por ejemplo, al reaccionar el óxido de cobre con el dióxido de carbono presente en el aire, se producen carbonatos de cobre en un par de reacciones que generan el color de la pátina sobre el metal[1], esto es:
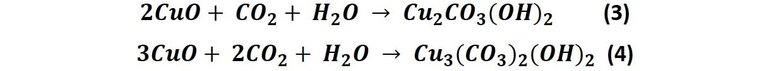
En la reacción 3 se produce un compuesto denominado malaquita (Cu2CO3(OH)2), específicamente es el dihidróxido de cobre (II), antiguamente muy utilizado como colorante[2]; este compuesto que varía de color verde oscuro a azul, en la reacción 4 se produce un compuesto llamado azurita (Cu3(CO3)2(OH)2) este es un compuesto que varía desde tonos azules a purpura. Aunque ambos compuestos son carbonatos básicos de cobre, la diferencia en los colores se debe a los diferentes estados de oxidación del metal en ambas formulas químicas[3].
Otra reacción que puede influir en el color de la pátina es la que se produce cuando el óxido de cobre reacciona con el óxido de azufre que se encuentra en el aire producto de la combustión de combustibles fósiles. Esto produce la siguiente reacción:
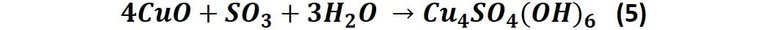
Al compuesto Cu4SO4(OH)6 se le conoce como brochantita, y es de color verde esmeralda.
Es por ello que la pátina que se produce sobre las esculturas expuestas al ambiente puede tener un color que varía entre tonos verdes y azules. Y por eso les decía que los patrones de la pátina dependen de la historia que ha tenido cada objeto de cobre. Así, los productos de las reacciones anteriores tienen su propio matiz de color, y la combinación de ellos describen una característica única de la pátina. Por ejemplo, los verdes más oscuros indican abundancia de malaquita y brochantita, producto de un ambiente con altas concentraciones de CO2 y SO3.
Entonces, así como vemos, la pátina se produce sobre el cobre producto de reacciones químicas, mientras más compuestos interactúen con el metal más productos se formaran, son varios los factores que influyen en la rapidez de la formación de la pátina y en el color que adopta, pero de forma general, propios del tipo de aleación y el entorno, pero de forma general se produce como hemos establecido.
Ahora bien, cuando se mezclan diferentes compuestos sobre la superficie del objeto de cobre se produce un agradable brillo de colores que a veces varias entre turquesa y esmeralda, que hacen de esta pátina un atractivo efecto decorativo muy buscado.
Como crear tu propia pátina
Como les decía, en la joyería y elaboración de ornamentos, los tonos azules y esmeralda de esta pátina es muy buscada como efecto decorativo en las piezas de cobre. Por eso podemos intentar reproducir esta pátina que se desarrolla naturalmente, pero que en la práctica se requiere desarrollarla de forma rápida. Así que vamos a ver cómo podemos hacerlo.
Procedimiento y resultados
Experimento n° 1. Pátina sobre una moneda
Este experimento es muy sencillo, solo vamos a necesitar una moneda recubierta de cobre, vinagre blanco y un poco de sal. En un recipiente vamos a agregar un poco de vinagre con una pisca de sal disuelta, y vamos a dejar en remojo la moneda por algunas horas.
Al poco tiempo comenzaremos a observar que la moneda se va oscureciendo, perdiendo el brillo metálico, y que además comienzan a aparecer zonas verdosas. En las siguientes imágenes les muestro el avance de la reacción sobre la moneda en remojo.
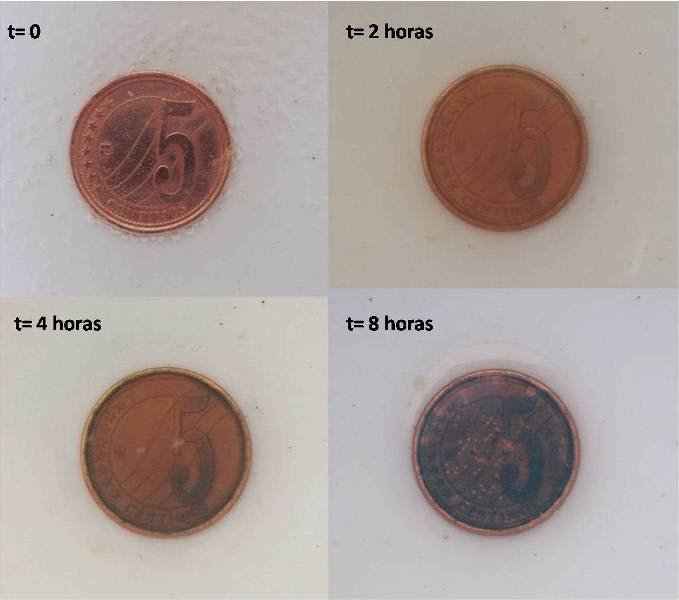
Imagen de como se va produciendo la pátina sobre la moneda sumegidaen la solución. Fuente: @emiliomoron.
Como podemos apreciar, la moneda va cambiando a un tono oscuro, señal de que se está oxidando, y que luego tiene lugar la aparición de manchas verdosas que se van propagando por toda la superficie de la moneda. Lo que estamos viendo es la formación de una pátina de color azul o verde conocida como cardenillo o verdín[4], la cual, a diferencia de las pátinas anteriormente descritas que se derivan de los carbonatos de cobre, esta se produce principalmente por la aparición de acetato de cobre (II).
Entonces, esta pátina que estamos generando de forma rápida y artificial si se quiere decir, es consecuencia de la acción que tiene el ácido acético (vinagre) sobre el cobre, específicamente sobre el óxido de cobre que se produce en la reacción 2, el proceso se puede describir mediante la siguiente reacción:
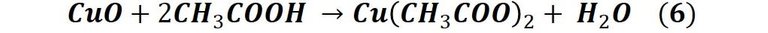
En la siguiente imagen podemos observar el aspecto de la moneda una vez que se retira de la solución y se deja secar al sol.

Aspecto de la pátina sobre la moneda después de retirar de la solución y dejar secar. Fuente: @emiliomoron.
Como podemos observar, una vez que se ha dejado secar, se aprecia mucho mejor el color verdoso de la pátina, dándonos esa apariencia de envejecido sobre la moneda.
Precaución
Con este experimento pude notar que prolongar el remojo de la moneda en la solución promueve un crecimiento excesivo del acetato de cobre sobre sobra la superficie, que luego se desprende fácilmente al tocar con los dedos, por lo que para lograr una pátina con poco espesor y mejor adherida a la superficie es recomendable retirar de la solución al observar que ya se ha cubierto con el tono verde según lo deseado.
Experimento n° 2. Pátina sobre un tubo de cobre
Como consecuencia de la observación descrita en la precaución, quise ver si era posible controlar mejor el crecimiento de la pátina; así que tome un trozo de tubo de cobre de aproximadamente 10 cm de longitud, limpio y libre de óxido lo mejor posible, y en lugar de remojarlo en la solución de vinagre y sal, le apliqué esta con una esponja. Y procedí de la siguiente manera; impregnaba la superficie del tubo con la solución utilizando la esponja, dejaba secar por una par de horas, y repetía el procedimiento, hice esto cuatro veces. Así logre el siguiente resultado.

Desarrollo de la pátina de cardenillo sobre un trozo de tubo de cobre. Fuente: @emiliomoron.
En la imagen podemos observar que el tubo se oscurece hasta un color marrón oscuro, señal que se ha formado el óxido de cobre (II), y se observan manchas color turquesa algo dispersas en la superficie. Estas manchas turquesa corresponden a la pátina de cardenillo, que como se puede observar, en este caso es más delgada y difuminada en comparación con la formada sobre la moneda, dejando ver más del color del tubo. Creo que se logra con este método un aspecto de envejecimiento más delicado que con el método anterior.
Conclusión y aporte
Bueno amigos, como hemos podido comprender, la formación de la pátina de cardenillo sobre las piezas de cobre se debe a un proceso químico, que corresponde a un conjunto de reacciones que tienen lugar entre el óxido de cobre que se produce de forma natural sobre el metal por su contacto con el oxígeno del aire, y la posterior reacción de este con algunos compuestos presentes en el ambiente, por lo que sus colores y patrones dependen mucho de la calidad del aire presente, por lo que son varios los factores de los que depende la rapidez con la que se forma y el color que adopta.
Las formas aquí descritas para recrear la pátina de cardenillo sirven de guía y pueden emplearse para decorar piezas ornamentales de cobre, reproduciendo ese aspecto de envejecido en poco tiempo. Creo que con algo de práctica y paciencia se podrían lograr patrones realmente artísticos, controlando el espesor y el patrón de la pátina con la forma de aplicación de la solución, pero su humilde servidor se limitó explorar la química del proceso.
Estas patinas nos dan un aspecto realmente asombroso en los objetos de cobre que utilizamos como decoración o en nuestros monumentos, quizás más de una vez hemos apreciado ese aspecto envejecido de nuestras esculturas pensando en su pasado histórico, sin notar que esa nostalgia es producida por el aspecto de una pátina debida a una reacción química. Por así decirlo, una pátina muy famosa y que ha maravillado a muchos se encuentra cubriendo la estatua de la libertad, creo que pocos creerían hoy al ver el tono verde de esta imponente figura, que cuando llego a Nueva York era de color marrón cobrizo.

Estatua de la Libertad y su característico color verde producto de la pátina de cardenillo. Fuente: pxhere.com.
Bueno amigos, hasta aquí el presente post. Espero que hayan encontrado interesante la información compartida, y que si se disponen a recrear la pátina en algun objeto de cobre me cuenten luego como les quedo. Hasta la próxima!
Referencias
- Wikipedia.com. Pátina (cobre)
- Wikipedia.com. Malaquita
- Wikipedia.com. Azurita.
- Wikipedia.com. Cardenillo
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
No sabía que la estatua de la libertad solía tener otro color. Algo similar debe haber sucedido con otras estructuras de acero en el mundo, como la torre Eiffel. Buen contenido de química ilustrando el proceso químico que acompaña al cobre para formar la pátina. Saludos!
Así es amigo @acont, creo que pocos nos lo imaginamos, según leí, incluso cuando hace alguna reparación mayor evitan a toda costa remover la pátina para no descubrir el color original, ya que la población ya ha admitido el verde como su color característico. En el caso de las estructuras de acero estan no desarrollan una pátina, por eso hay que pintarlas para protegerlas, pero otras estructuras de cobre en el mundo si, como la catedral de Berlín, el ayuntamiento de Minneapolis por citar alguno de los que me encontre.
Cierto, eso no ocurre en estructuras de acero, gracias por la corrección. Saludos!
Excelente material compañero @emiliomoron, dado que nos presentas experimentos que podemos hacer en nuestras casas y así afianzar las ideas. Tengo esta pregunta:¿la formación de la pátina puede ser vista como un problema? O al contrario, su formación es un acontecimiento que favorece la estética de las estructuras de cobre. Saludos desde Arequipa!!!
Saludos amigo @eliaschess333, que tal todo por Arequipa? Esa es la idea, poder aplicar este conocimiento en casa y reforzar la explicación con la experimentación. Desde el punto de vista de la integridad del material no es un problema, al contrario, esta pátina lo protege de la corrosión, solo sería un problema si deseas que el objeto mantenga el color metálico, lo cual requeriría de mantenimiento constante. Ahora que, desde el punto de vista estético en muchos casos es bastante apreciado, en la fachada de algunos edificios se ha utilizado el cobre o alguna aleación de este pensando que en el futuro adquiriría una pátina de color azul o verde.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Muchas gracias por el apoyo amigos!
Aunque prefiero mantener una moneda de colección algo más brillante, yo mantendría la pátina producida en las piezas históricas, pues le dan ese toque de antaño, de sapiencia y nos traslada al arte medieval con su elaborada orfebrería. Excelente publicación @emiliomoron
Saludos amigo @iamphysical. Ciertamente que en las piezas históricas la pátina le da ese aspecto de antaño que nos evoca gratas sensaciones. Saludos amigo, gracias por pasar a leer.