Formación de oxihidróxido de hierro
Saludos estimados amigos de Hive, especialmente a la comunidad de #STEM-espanol.
La formación de precipitados es una de las reacciones que más me fascinan de la química, la aparición repentina de una fase solida en el seno de un disolución resulta muy interesante para el ojo del experimentador, y si esta va acompañada de un llamativo cambio de color, resulta más interesante aún. Y en esto, los hidróxidos parecen ser un excelente modelo para demostrar este tipo de reacciones, especialmente los hidróxidos de hierro tienen la particularidad de formar sistemas coloidales muy estables con colores muy característicos, lo que nos permite evidenciar muy fácilmente el fenómeno de precipitación de hidróxidos.

Los hidróxidos de hierro nos sorprenden con llamativos colores. Fuente: @emiliomoron.
Pero, ¿qué es un oxihidróxido?
Estoy seguro de que todos sabemos que son los óxidos metálicos, especialmente los óxidos de hierro, y estoy casi seguro de que sabemos cuáles son los hidróxidos. Pero por si las dudas recordemos que un óxido está formado por la unión de un elemento (metal o no metal) con el oxígeno; mientras que un hidróxido se produce por la unión de metal con el ion hidróxilo, OH-.
Mientras que los oxihidróxidos son compuestos ternarios en los que un metal se haya unido tanto a un ion OH- como a un ión O-2, por lo que se representan con la formula general MO(OH), siendo M el metal.
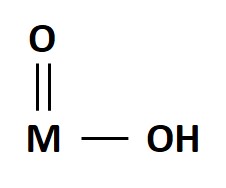
Esta es la estructura de las que se conocen más de estos compuestos, formados principalmente por Al, Sc, V, Fe, Co, Ga e In[1]. Por lo que es evidente que para darse esta estructura el número de oxidación del metal de ser mínimo igual a +3 para poder igualar al de los iones oxido (-2) e hidróxido (-1). Por otro lado, varios de estos compuestos existen con formas α y γ.
De estas formas el oxihidróxido de hierro, de formula general FeO(OH) parece sobresalir con distintos tipos, los cuales son de mucho interés en la industria de la metalurgia; por ejemplo, la forma α-FeO(OH) en su estado natural se conoce como goetita, presenta un color pardo rojizo o pardo amarillento, siendo su principal uso como mena de hierro[2].

Goetita, forma mineral del α-FeO(OH). Fuente: wikipedia.com, imagen CC0.
Otras formas del oxihidróxido de hierro son:
• akaganéite (β-FeOOH),
• lepidocrocite (γ-FeOOH)
Para la industria de la metalúrgica extractiva la precipitación de hierro es sumamente importante, ya que el hierro disuelto tiene que ser procesado antes del tratamiento de las soluciones de lixiviación para poder recuperar el metal deseado[3]. Por esta razón, se ha dedicado una cantidad considerable de esfuerzo a la investigación del comportamiento de la precipitación de los hidróxidos de hierro desde soluciones sintéticas.
Descripción del experimento
Esta experiencia tiene como finalidad facilitar al lector, que puede ser un estudiante que busca información sobre la formación de precipitados o un docente que busca una experiencia sencilla para demostrar la diferenciación experimental entre los hidróxidos y oxihidróxidos; o simplemente para nuestra comunidad para que se maraville con la experiencia misma.
Partiremos de una disolución de sulfato de hierro (II), esta sal es muy común en los laboratorios y es fácil de conseguir; para ello disolveremos pocos gramos en agua destilada, yo he empleado el equivalente a la punta de la espátula en 50 mL de agua destilada para hacer una experiencia puramente cualitativa. Y luego trataremos de obtener acuacomplejos de hierro con sus dos estados de oxidación habituales, III y II, empleando un medio alcalino con la adición de hidróxido de sodio (NaOH) concentrado, para luego oxidar el hidróxido con un oxidante no muy fuerte, en este caso peróxido de hidrogeno (H2O2), o agua oxigenada 3%.
La primera reacción a realizar será mediante la adición de hidróxido de sodio en la disolución de sulfato de hierro (II). En las siguientes imágenes podemos ver como procede la reacción con la adición gota a gota del reactivo.
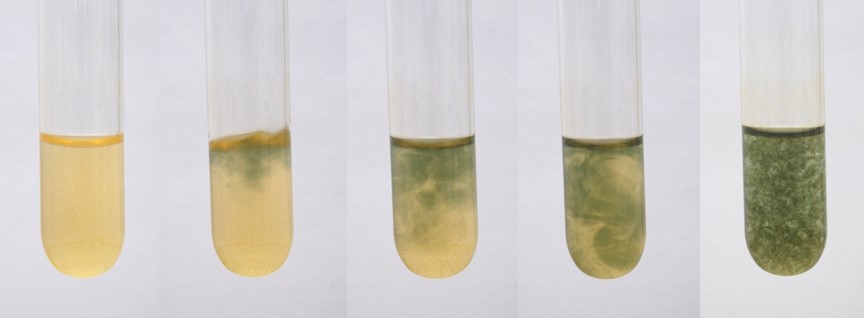
Formación del precipitado Fe(OH)2. Fuente: @emiliomoron.
En la tira de imágenes se puede observar la formación del hidróxido de hierro (II), un precipitado de apariencia gelatinosa de color verde oscuro, cuando se hace reaccionar la disolución de sulfato de hierro (II) de color amarillo pálido con hidróxido de sodio. El proceso químico se puede ilustrar mediante la siguiente reacción:
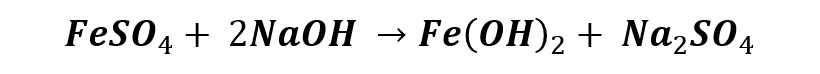
Ahora partiremos de la disolución que contiene el precipitado de hidróxido de hierro (II), y a esta solución añadiremos peróxido de hidrogeno o agua oxigenada.

Formación del precipitado FeO(OH). Fuente: @emiliomoron.
En la tira de imágenes podemos observar el resultado de un proceso redox que conduce a la formación del oxihidróxido de hierro (III), un precipitado de color rojo naranja. La reacción general se puede expresar de la siguiente forma:
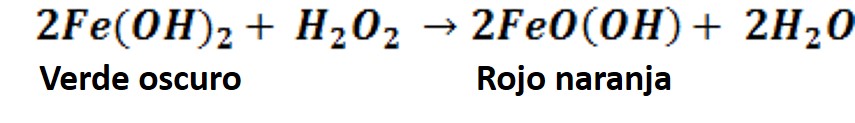
El conjunto de semireacciones del proceso redox se pueden escribir de la siguiente manera:
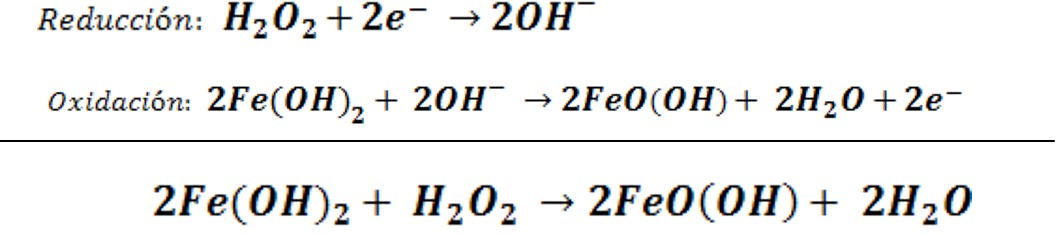
En el siguiente video les muestro el proceso en forma general.
Obtención de oxihidróxido de hierro. Fuente: @emiliomoron.
Bueno amigos, espero que hayan disfrutado del experimento, hasta la próxima!

Referencias:
- Wells, A. F. (1978). Química inorgánica estructural. Editorial Reverte S.A.
- Wikipedia.com. Goethita.
- Barik, R. and Mohapatra, M. (2011). Facile precipitation and phase formation of iron oxide with in situ Fe(II) in Fe2(SO4)3-NaOH-(N2H4)2H2SO4-H2O medium. Indian Journal of Chemical Technology Vol.18, March 2011, pp. 107-112.
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Very nice article! Thanks for sharing.
!discovery 30
Many Thanks @delilhavores!
This post was shared and voted inside the discord by the curators team of discovery-it
Join our community! hive-193212
Discovery-it is also a Witness, vote for us here
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @steemstem account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
thanks my friends!
Es interesante descubrir exactamente por qué el metal se oxida, más allá de "se dejó a la intemperie". Pregunto, que tratamiento recibe el acero inoxidable para tener esa cualidad?
Saludos @mike961. Ciertamente que la respuesta es más compleja que solo "se dejó a la intemperie" jeje. El acero inoxidable básicamente es una aleación de hierro y carbono pero que además contiene cromo y níquel. Realmente si se oxida, pero quien lo hace más rápido es el cromo y al hacerlo crea una película muy delgada de óxido de cromo sobre la superficie que protege al material de los elementos corrosivos del ambiente. Gracias por pasar a leer y dejar tu comentario, espero haberte respondido, quizás alargue esta idea en un post.
Excelente material estimado @emiliomoron desde el punto de vista científico y didáctico. De gran importancia para la EducaciónSTEM ...felicitaciones!