Demostración sencilla de cómo se oxida el hierro
La oxidación de los metales, especialmente hierro, es un tema muy importante desde el punto de vista de nuestra tecnología actual, ya que básicamente cualquier elemento constructivo tiene una estructura o contiene diversos elementos metálicos, comúnmente acero por su versatilidad; y las propiedades mecánicas de estos, además de su aspecto visual, empeoran al sufrir la oxidación, por no decir el impacto económico que esto tiene. Por lo que la comprensión del proceso de oxidación y corrosión del hierro es muy importante para cualquier persona ligada al trabajo con este elemento.
 Estos protectores en mi casa ya requieren de mantenimiento ante la corrosión. Fuente: @emiliomoron.
Estos protectores en mi casa ya requieren de mantenimiento ante la corrosión. Fuente: @emiliomoron.En este artículo les muestro una sencilla experiencia que se puede realizar en casa con materiales de los que casi todos disponemos para poner de manifiesto este importante fenómeno, y nos permite abordar de manera sencilla el estudio de las reacciones de óxido-reducción.
¿Por qué se oxida el hierro?
Podemos decir que de cierta forma la oxidación de los metales es inevitable, salvo algunas excepciones (como el oro y el platino), no existen en la naturaleza en su estado metálico, sino en combinación con algún otro elemento, en forma de minerales como óxidos, carbonatos o sulfatos.
Cuando se produce el acero básicamente utilizamos grandes cantidades de energía para liberar el hierro del resto de los elementos con los cuales se encuentra combinado. Pero si requiere gran cantidad de energía llevar el hierro a su estado metálico es porque entonces esta no es su forma más estable, así que la oxidación puede verse como un retorno de los metales a su estado natural. En el caso del hierro su forma natural más común es la hematita, que es un óxido de formula Fe2O3[1].
Entonces, la fuerza impulsora que hace que un metal se oxide es su tendencia a volver a su estado combinado (oxidado en el caso del hierro); pero para retornar a este estado se requiere de una reacción química para pasar a un estado oxidado. Esta reacción es la que conocemos como redox, o de óxido-reducción, un tipo de reacción química donde los reactivos intercambian electrones de forma que el estado de oxidación de cada uno aumenta o disminuye.
Durante una reacción de óxido-reducción, o redox, se producen cambios químicos en las especies implicadas, por un lado la especie que se oxida sufre una pérdida de electrones, aumentando su estado de oxidación. Estos electrones fluyen hacia otra especie que actúa como agente oxidante sufriendo una reducción de su estado de oxidación[2].
Los elementos en su estado fundamental, o molecular en el caso de los gases, tienen un estado de oxidación 0, y cuando se oxidan este número aumenta. Por ejemplo, el hierro cuando se oxida en presencia de oxígeno pasa de su estado de oxidación 0 a +2, debido a la transferencia de dos electrones al oxígeno que cambia su estado de oxidación de 0 a -2.
De forma general podemos representar la reacción como:
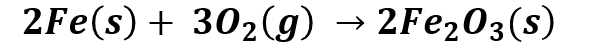
Procedimiento y discusión
El procedimiento es muy sencillo, solo vamos a necesitar un par de platos plásticos desechables, un par de clavos comunes de hierro, agua y un poco de sal.
Antes de iniciar conviene limpiar y lijar la superficie de ambos clavos para eliminar cualquier mancha de óxido que pudieran tener, y así ambos clavos partirían de un aspecto similar.
 Aspecto inicial de los clavos utilizados en el experimento. Fuente: @emiliomoron.
Aspecto inicial de los clavos utilizados en el experimento. Fuente: @emiliomoron.Tomaremos los dos platos e identificaremos, al primero le agregaremos agua común del grifo y al segundo agua con un poco de sal de mesa; y en cada plato vamos a colocar un clavo de hierro (el agua en cada plato debe ser suficiente para dejar parte de la superficie del clavo expuesta).
 Plato n° 1: clavo colocado en agua común. Fuente: @emiliomoron.
Plato n° 1: clavo colocado en agua común. Fuente: @emiliomoron.En el plato n°1, donde tenemos el clavo sumergido en agua común, la cual contiene algunas sales y oxígeno disuelto, al cabo de algunas horas comenzamos a observar que el agua en las proximidades del clavo se va tornando de un color naranja, lo que nos da indicios de que la reacción de oxidación ha iniciado.
 Aspecto del agua en las proximidades del clavo en el plato n°1 al cabo de unas horas. Fuente: @emiliomoron.
Aspecto del agua en las proximidades del clavo en el plato n°1 al cabo de unas horas. Fuente: @emiliomoron.Esta reacción se lleva a cabo básicamente porque en el clavo se producen algunas zonas que funcionan como pequeñas celdas electroquímicas, por un lado, en algunas zonas se produce la reacción de oxidación (zonas anódicas) y en otras zonas la reacción de reducción (zonas catódicas).
En las zonas anódicas se produce la oxidación del hierro según la semireacción:
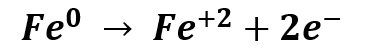
Y en las zonas catódicas se produce la reducción del oxígeno:
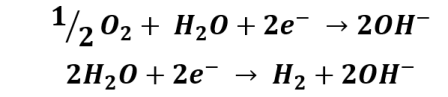
En la siguiente figura podemos observar una representación del proceso.
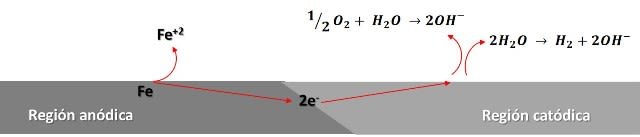 Representación de las reacciones del proceso de oxidación del hierro. Fuente: @emiliomoron.
Representación de las reacciones del proceso de oxidación del hierro. Fuente: @emiliomoron.Las zonas anódicas y catódicas no necesariamente se ubican en sitios opuestos, por lo general las zonas catódicas suelen ubicarse donde la concentración de oxígeno es mayor, y por el contrario, las zonas anódicas suelen ubicarse donde la concentración de oxígeno es menor, esto es común en el ambiente ya que la superficie del metal expuesta a la atmosfera puede variar, por ejemplo; lo que ocurre cuando tenemos parte del clavo sumergido en el agua, como la concentración de oxígeno es mayor en la superficie expuesta al aire en esta tendera a ubicarse la zona catódica, no observándose tanta oxidación en esta parte. Y las zonas anódicas estarán preferiblemente ubicadas en la superficie sumergida, con menor concentración de oxígeno, produciéndose la oxidación del clavo en esta parte, disolviendo los iones hierro en la solución.
En el agua, con un pH cercano al neutro, y en presencia de oxígeno, la reacción global de oxidación del clavo puede representarse de la siguiente forma:
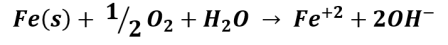
Luego, los iones hierro Fe+2 reaccionan con el oxígeno disuelto del agua produciendo un precipitado de óxido férrico hidratado, de color naranja rojizo.
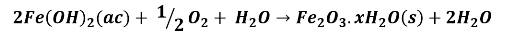
Por ello, con el transcurrir del tiempo el clavo se oxida convirtiéndose en óxido férrico, también llamado herrumbre.
En el plato n°1 en la que el clavo está sumergido en agua común el proceso es relativamente lento; sin embargo, cuando comparamos con el proceso llevado a cabo en el plato n°2, done el calvo está sumergido en agua con un poco de sal de mesa disuelta, podemos observar que el proceso es mucho más rápido. En las siguientes imágenes podemos comparar como se va coloreando la disolución con el óxido férrico a medida que transcurre el tiempo del experimento.
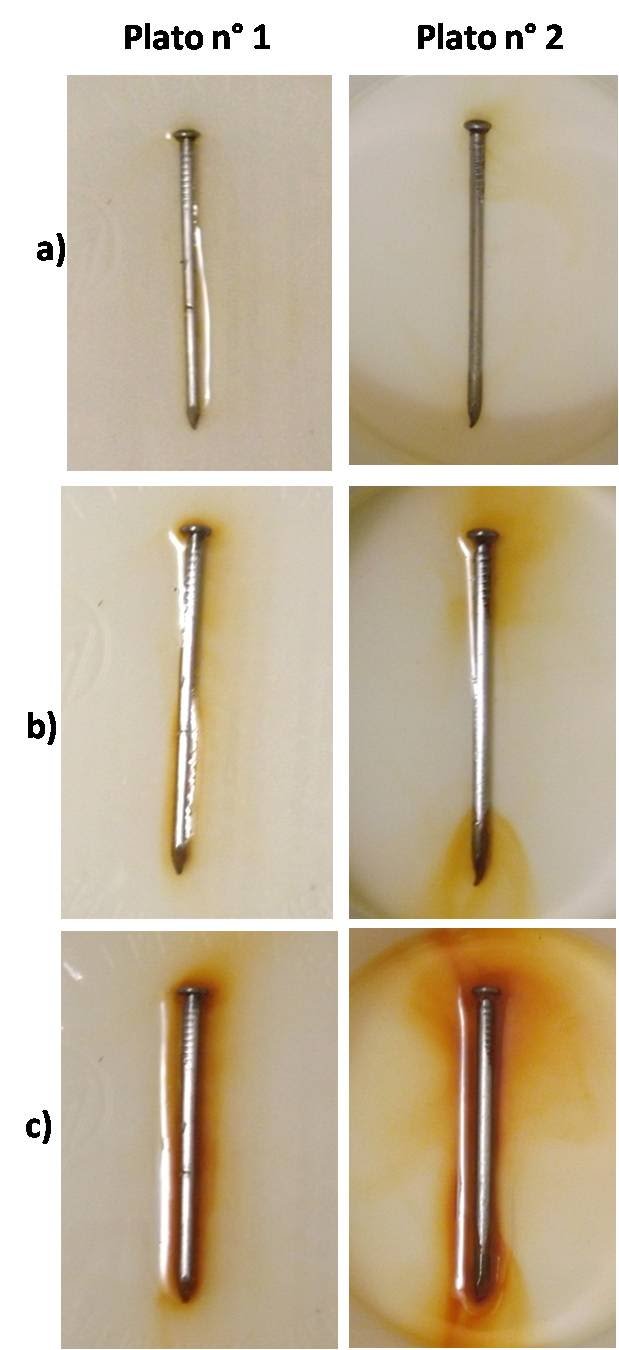 Comparación del avance de la oxidación en ambos platos a las: a) 4 horas, b) 12 horas y c) 24 horas. Fuente: @emiliomoron.
Comparación del avance de la oxidación en ambos platos a las: a) 4 horas, b) 12 horas y c) 24 horas. Fuente: @emiliomoron.Esto se debe a que la oxidación es un proceso electroquímico, así que requiere de la transferencia de carga; y como la sal disuelta incrementa la conductividad del medio favorece en transporte de carga en la disolución, acelerando el proceso. Es por ello que en los ambientes salinos la corrosión del hierro es más rápida.
En estas imágenes podemos comparar el aspecto de ambos clavos al retirar de la solución y dejar secar.
 Comparación de la oxidación de los clavos, a la izquierda el colocado en agua común y a la derecha el colocado en agua salada. Fuente: @emiliomoron.
Comparación de la oxidación de los clavos, a la izquierda el colocado en agua común y a la derecha el colocado en agua salada. Fuente: @emiliomoron.Como se puede observar, hay mayor corrosión en el clavo colocado en agua salada.
En la siguiente imagen podemos observar el agua recolectada del plato n°2, el precipitado de aspecto coloidal de color rojizo es el óxido férrico hidratado, luego de algunas horas se puede ver que este se deposita en el fondo del recipiente.
 Aspecto de la solución que contiene el óxido férrico (izquierda) y el precipitado (derecha) después de unas horas de reposo. Fuente: @emiliomoron.
Aspecto de la solución que contiene el óxido férrico (izquierda) y el precipitado (derecha) después de unas horas de reposo. Fuente: @emiliomoron.Este mismo sólido rojizo es el que se deposita sobre la piezas de hierro en el ambiente, formando una capa fácil de remover de la superficie, seguro que más de uno recordara en este momento haberse manchado las manos al tocar una pieza de hierro oxidado; es por eso que el proceso de oxidación no se detiene solo en la superficie, sino que prosigue desprendiendo poco a poco el material, así, con el paso el tiempo se convertirá en óxido la totalidad de la pieza.
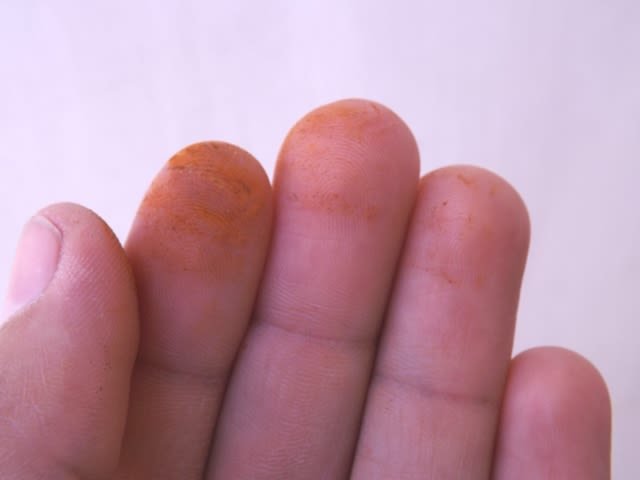 Manchas de óxido férrico en las manos. Fuente: @emiliomoron.
Manchas de óxido férrico en las manos. Fuente: @emiliomoron.Aportes
Con este artículo espero haber compartido información de su interés sobre el proceso de oxidación. Que, como hemos visto, la oxidación de un elemento de hierro expuesto a la humedad y al aire no tarda mucho en hacerse notar, permitiendo realizar esta experiencia mediante la cual resulta fácil de demostrar dicho proceso. Y con ello, sirve de guía para llevar a cabo experiencias didácticas en casa con materiales y reactivos que tenemos disponibles en el hogar. Este tipo de experimento se puede realizar cuando se estudian las reacciones de óxido-reducción, estimulando así la curiosidad y el análisis de los estudiantes por los procesos químicos que ocurren en los metales de uso cotidiano.
Bueno amigos, es todo por los momentos, espero que la información les sea útil, muchas gracias por pasar a leer el post. ¡Hasta el próximo!
Referencias
- Wikipedia.com. Óxidos de hierro.
- Chang, R. (2002)- Química. 7ma edición. McGraw-Hill.
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Saludos @emiliomoron, que manera tan didáctica de demostrarnos el proceso de oxidación, el ensayo demostró como la sal aumento el proceso de corrosión. Te felicito buen trabajo !👍
Muchas gracias @amestyj, esa era la idea, hacer una demostración sencilla del fenómeno que nos ayude a comprender el proceso y como el ambiente salino lo acelera, gracias por pasar a leer, saludos!
Muy bueno tu post estimado @emiliomoron. Fue todo un gusto leer tu post. Interesante presentación de este fenómeno que ocurre a diario y que tratamos de retardar lo más posible en nuestras casas, en el carro, etc. Gracias por compartirlo. Saludos cordiales.
Muchas gracias estimado @tsoldovieri, gracias a ti por pasar a leer. Ciertamente es un fenómeno que ocurre a diario y solemos pasar por alto la ciencia implicada en el fenómeno, la explicación no solo ayuda a los estudiantes de química a entender las reacciones sino que a todos nos sirve para buscar soluciones que ayuden de retardar el proceso. Mis saludos!
Una forma muy didáctica para dar a conocer el por qué cerca del mar, como siempre se percibe, todo se aprecia oxidado. Saludos estimado @emiliomoron.
Así es amigo @capp. Es una forma muy sencilla de explicar porque en un ambiente salino los metales se oxidan más rápido. Saludos mi estimado, gracias por pasar a leer.
Muy importante este post en el orden de la ingeniería, ya que aquellos especialistas en resistencia de materiales deben cuidar el desgaste de ciertas estructuras tomando en cuenta al grado de oxidación de algunos metales, y que mejor forma de aprender estas generalidades que el contenido que esta vez nos compartes estimado amigo @emiliomoron. Saludos y gracias por compartir
Saludos @carlos84. Ciertamente es muy importante cuando se habla de estructuras metálicas, ya que su resistencia se ve comprometida por el grado de oxidación. Muchas gracias por tu valoración del artículo, sin duda que los conceptos quedan más claros con una demostración.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Muchas gracias por el apoyo amigos!
Congratulations @emiliomoron! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board And compare to others on the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!