Demostración sencilla de cómo se oxida el cobre

Segmentos de alambre de cobre, limpio y oxidado. Fuente: @emiliomoron.
El cobre pertenece al grupo de los metales noble, se encuentra junto al oro y la plata en la tabla periódica en el grupo IB, siendo uno de los metales inertes y fácilmente conseguible en la superficie terrestre en su forma metálica, aunque podría decirse que es el menos noble del grupo, pero esto le otorga buenas propiedades respecto a la oxidación. A temperatura ambiente y condiciones normales, este se oxida formando una película delgada de óxido cúprico, que luego pasa a oxido cuproso, y que también se cubre de otros compuestos como sulfatos y carbonatos, lo que propicia una capa protectora de color verde[1], un efecto a veces perseguido como decoración.
Y aunque en atmosferas secas el cobre es muy resistente a la corrosión, en ambientes ácidos el cobre es atacado por la oxidación, es soluble en ácidos como el sulfúrico y clorhídrico formando coloridos complejos, el ácido acético lo ataca formando una capa verde o azul verdosa. Y aunque el agua común no lo corroe, el agua de mar puede producir un ataque moderado. Por eso en esta ocasión vamos a demostrar cómo se oxida en cobre bajo ambientes más agresivos, observando la reacción producida al exponerlo a una solución salina y a otra ácida.
Procedimiento y discusión
Esta demostración es muy fácil de realizar, solo vamos a necesitar un par de piezas de cobre, pueden ser dos trozos de tubería o de cable conductor, yo elegí trabajar con el cable ya que tenía disponible, corte dos segmentos de aproximadamente 5 cm cada uno y retire la cubierta protectora de plástico. Cualquiera que sea la pieza a utilizar asegúrate que esté limpia y libre de manchas para que inicien con un aspecto similar.
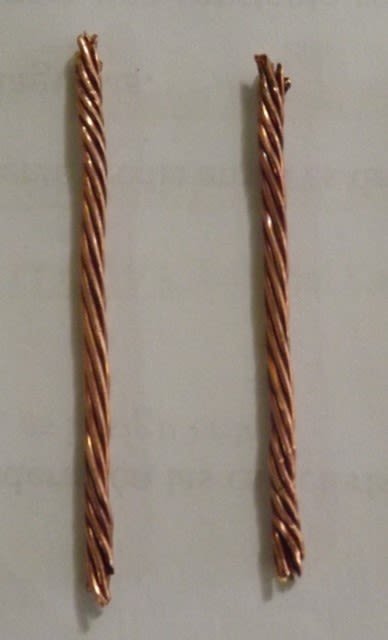
Trozos de cable de cobre utilizados en el experimento. Fuente: @emiliomoron.
También vamos a necesitar un poco de agua con sal disuelta y una solución ácida, esta no es difícil de conseguir ya que varios limpiadores de baños son en base a ácido clorhídrico, yo he utilizado una disolución de ácido sulfúrico ya que tenía disponible un poco de ácido de batería. También vamos a necesitar un par de envases plásticos.
Tomaremos los envases e identificaremos, en uno agregaremos un poco de agua con sal y en el otro la solución ácida, y en cada envase colocaremos las piezas de cobre. La solución debe ser suficiente para dejar una parte de la superficie expuesta.

Condición inicial del experimento, envase con el alambre en la disolución ácida. Fuente: @emiliomoron.
En el envase n°1, con la solución salina, al cabo de unas horas no se observa indicios de reacción, sin embargo en el envase n°2, con la solución ácida, empieza a observarse la formación de una solución turquesa alrededor del cable de cobre. en la siguiente secuencia de imágenes podemos observar como avanzó la oxidación en ambos alambres.
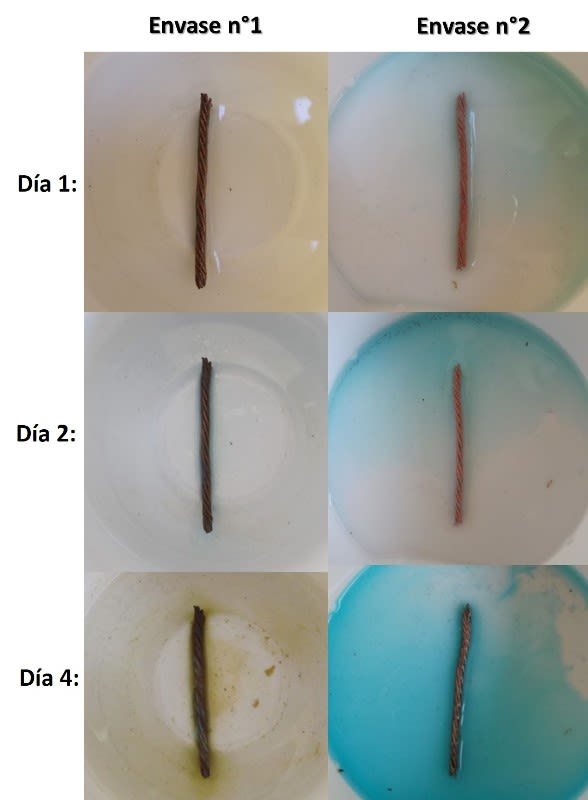
Avance de la oxidación en el experimento. Fuente: @emiliomoron.
En soluciones acuosas, el cobre tiende a ser un metal estable en ausencia de oxígeno, debido a que su potencial de reducción es mayor que el potencial de reducción del agua, independientemente del pH de la solución. Sin embargo, en presencia de oxígeno el cobre si se oxida de acuerdo a la siguiente reacción:
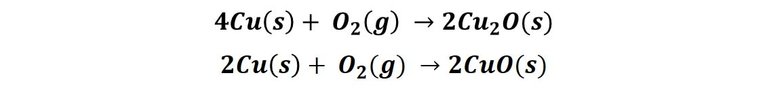
Expuesto al ambiente, primero se forma el óxido de cobre (I) también llamado óxido cuproso, un oxido de color rojo[2], posteriormente tiene lugar la segunda reacción, formándose el óxido de cobre (I), también óxido cuproso, este compuesto es de color negro[3]. Luego, en presencia de los contaminantes atmosféricos, estos compuestos reaccionan para formar la pátina que cubre el metal. En presencia de CO2 reaccionan para para formar CuCO3 de color verde, un compuesto conocido como cardenillo. El agua salada del envase n°1 acelera el proceso, por eso observamos que alrededor del cable se van oscureciendo algunas zonas.
En el plato n°2, que contiene la solución acida, el proceso es muchos más rápido. En este envase, el medio ácido disuelve los óxidos del metal, dejando libre la superficie, es decir, sin la formación de la pátina. El proceso se describe según la reacción:
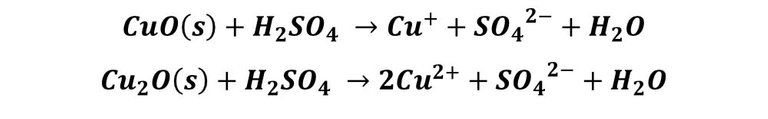
La disolución resultante va adquiriendo un color azul debido a la formación de complejos de Cu+ y Cu2+ con los iones SO42- y con el agua.
Como se puede observar, en ambos medios la corrosión avanza de forma diferente. En el medio ácido el ataque es más rápido observándose como muy pronto la solución va tornándose azul en las proximidades del cable. Mientras que en el envase n°1 vemos un progreso muy lento el primer día del experimento. A los cuatro días podemos observar como el aspecto de los cables es diferente; en el envase n°1 el cable se ha oscurecido y se puede notar la presencia de una solución marrón en las proximidades de este, por lo que podemos deducir que en este medio la tendencia es a formar el CuO de color negro, además de que podemos notar la presencia de un deposito color verde entre los hilos entrelazados.
Por otro lado en el cable del envase n°2 podemos observar zonas de color rojo y una mayor proporción de superficie cubierta por la formación de la capa de color azul verdoso. En este caso vemos que el medio ácido los óxidos son inestables y no perduran sobre la superficie del metal, y tiene lugar el ataque químico del material, teniendo en las proximidades del cobre mayor interacción de los iones cobre Cu2+ con los iones SO42-, precipitando CuSO4, resultando la formación de una capa doble, que contiene CuO y CuSO4.
En la siguiente imagen podemos comparar ambos trozos de cable después de retirar de la solución, lavar con agua y dejar secar.

Aspecto de los trozos de cable después del experimento. A la izquierda el cable del envase n°1 y a la derecha en cbla del envase n°2. Fuente: @emiliomoron.
Al comparar los cables fuera de la solución podemos observar la diferencia en la formación de la capa de óxido. El cable que estuvo en el agua salada se observa más oscuro, mientras que en dispuesto en la solución ácida aún se observa el color rojizo en las zonas donde no fue creada la pátina verdosa, evidenciando que en el primero prevalece la capa de óxido cuproso mientras que en el segundo los óxidos no son estables y se disuelven, incluso se puede apreciar al comparar ambos que el cable en el ácido ha perdido mayor cantidad de masa, es decir, mayor cantidad de iones de cobre que pasaron a formar parte de la disolución.
En la siguiente imagen podemos observar el color de la solución recolectada del envase n°2. Este color azul es producto de la formación del complejo Cu(H2O)62+.

Aspecto de la disolución ácida luego del experimento. Fuente: @emiliomoron.
Esta es otra experiencia que podemos realizar para observar como es la corrosión del cobre, si colocamos una moneda de cobre en una mezcla de agua oxigenada y la disolución ácida, podemos observar aún más rápido deterioro. Notándose como prevalece el óxido de color rojizo sobre la superficie de la moneda, deduciendo entonces que prevalece la formación del compuesto Cu2O en estas condiciones.

Deterioro de una moneda de cobre expuesta a un ambiente fuertemente oxidante por unas hoas. Fuente: @emiliomoron.
En este caso, como el agua oxigenada es un fuerte oxidante podemos observar que acelera la reacción de oxidación de cobre a Cu2+ en medio ácido. El proceso se puede representar según la reacción:
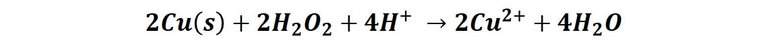
Es por ello que las monedas recubiertas de cobre van perdiendo su brillo metálico con la manipulación y tomando un aspecto rojizo.
Conclusión y aportes
Con la información presentada podemos poner en evidencia que la oxidación no es un proceso exclusivo de los materiales de hierro. En otros metales, como el cobre, a pesar que en un ambiente normal su oxidación es lenta y produce una capa pasiva de óxido que lo protege de la corrosión, bajo otras condiciones se puede producir su oxidación acelerada, evidenciando el color de los óxidos que se forman a partir de este e incluso los coloridos complejos que forman sus iones en solución. Este conocimiento es importante para elegir el tipo de material según el ambiente de trabajo, ya que si bien el cobre es un metal más noble que el hierro, bajo condiciones más severas de trabajo, como ambientes ácidos y salinos, igualmente se presentara su oxidación.
Con este experimento podemos proveerles a los estudiantes de química y de otras áreas afines, una demostración sencilla, con materiales de uso común, del proceso involucrado en la oxidación de elementos de cobre. Teniendo una forma didáctica de demostrar en casa los conceptos relacionados a la corrosión de este metal.
Bueno amigos, hasta aquí el presente el post, espero que les haya gustado el experimento y les sea útil la información, muchas gracias por pasar a leer. Hasta el próximo!
Referencias
- Wikipedia.com. Cobre
- Wikipedia. [Óxido de cobre (I)](https://es.wikipedia.org/wiki/%C3%93xido_de_cobre_(I)
- Wikipedia.com. [Óxido de cobre (II)]( https://es.wikipedia.org/wiki/%C3%93xido_de_cobre_(II)
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Esta publicación ha sido valorada por la comunidad @hivemexico.
Hive México es la unión de comunidades hispanas, que se enfoca en la orientación y educación, ademas de promover diversas actividades para usuarios no solamente mexicanos.
Muchas gracias @hivemx
Yo he visto en un caso donde dos tubos the cobre se cruzaron. En el punto de contacto, se hizo una fuga. Pienso que posiblemente habra sido que el material se desgasto al haberse creado una reaccion galvanica. Esto causo tremendo dano al hogar.
Saludos @facilitymanager. Bueno la reacción galvanica ocurre entre metales diferentes, sufriendo la corrosión el metal menos noble, quizás haya sido otra la causa la que origino el desgaste, quizás algun tipo de tensión causo corrosión por fatiga, esto también causa el desgaste del material.
Muy interesante tu contenido no tenia idea de como se oxida el cobre. Saludos muy importante información
Saludos @sandracarrascal. Me alegra que te gustara el contenido y te fuera útil la información, algunos óxidos son interesantes y no todos los metales se oxidan de la misma forma.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Thanks my friends!
Hola @emiliomoron.
Excelente post. Muy didáctico la parte experimental que prueba el grado se oxidación del cobre. Saludos y gracias por compartir
Saludos @carlos84.Muchas gracias a ti por pasar a leer, me alegra que te haya parecido bastante didáctico.
Buen trabajo mostrando este experimento, el proceso de oxidación del cobre (Cu). Demuestra que debemos proteger materiales útiles de los agentes externos, así no sean tan susceptibles a la corrosión como el hierro. Saludos!
Saludos amigo, muchas por pasar a leer, disculpa no haya visto antes tu comentario. Y así es, depende del uso pero siempre será aconsejable proteger los materiales metálicos de la corrosión causada por el ambiente. Saludos
Saludo amigo @emiliomoron, un material educativo y muy valioso, muy explicita disertación y los ejemplos quedan claros, he adquirido algunos conocimientos al respecto gracias a tus publicaciones, merece ser divulgado !
Hasta luego amigo, seguimos en comunicación !
Salaudos amigo, me disculpo por no haber visto antes tu comentario, me alegra que te gusten los experimentos y hayas adquirido algunos conocimientos al leer los posts, gracias por pasar a leerlos.