Cobreado electrolítico casero
Como sabemos, en la industria de los metales, la deposición de un metal sobre otro es ampliamente utilizada, como en el caso del hierro galvanizado comentado en otro post; y se usa bien sea para brindar protección ante la corrosión o para mejorar alguna propiedad en articular. En esto el cobre se destaca por su alta conductividad, ductilidad, resistencia a la corrosión, propiedades que propician su uso en múltiples aplicaciones, tanto en el sector industrial como en la decoración de piezas.

LLave que acaba de recibir una capa de cobre. Fuente: @emiliomoron.
Es por eso que el cobreado, es decir, el proceso empleado para recubrir una pieza de metal con una fina capa de cobre, es un procedimiento muy demandado, no solo en la industria de la protección de piezas metálicas sino también en la industria electrónica, ya que por su buena conductividad, el cobre es muy empleado en la fabricación de circuitos eléctricos. En esta ocasión traigo para compartir con ustedes un sencillo experimento donde podemos poner a prueba el principio químico involucrado en el proceso.
Ahora bien, el cobreado electrolítico es un procedimiento electroquímico mediante el cual, haciendo uso de la electrolisis, se recubre la superficie de un artículo con una capa de cobre. Este tiene lugar en una celda electrolítica en la cual, mediante el paso de corriente eléctrica directa, se disuelve un electrodo de cobre y sus iones son transportados hasta la superficie de la pieza[1]. En la celda se debe emplear una sustancia iónica que permita el paso de la corriente eléctrica desde el electrodo de cobre hasta la pieza a recubrir. En la celda, el electrodo de cobre constituye el ánodo y la pieza a recubrir el cátodo.
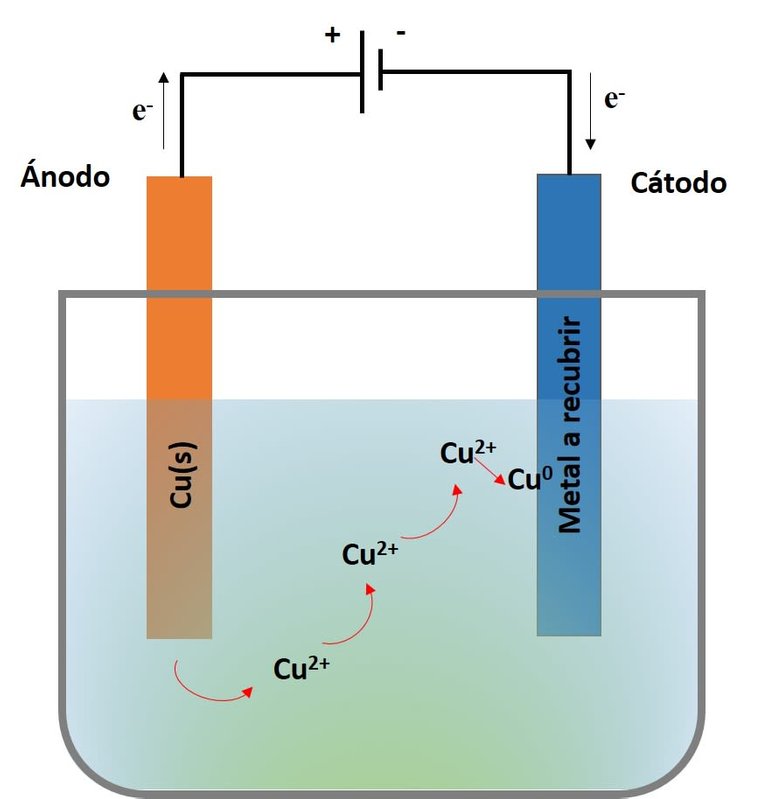
Esquema de la celda electrolítica para el cobreado. Fuente: @emiliomoron.
El flujo de la corriente eléctrica hace que el cobre se ionice al producir su oxidación, es decir, que cada átomo de cobre pierde electrones y se carga positivamente. A medida que los cationes se disuelven en la solución electrolítica, forman complejos con sales previamente presentes; entonces, el cobre, fluye hacia el objeto donde sufre una reducción, es decir, vuelve a ganar electrones, volviendo así a su estado metálico. Esto provoca que se deposite de forma sólida sobre el objeto formando una fina película que los recubre.
El cobreado es muy utilizado como acabado final en piezas de decoración, pero también es muy utilizado en la industria metalúrgica como acabado intermedio.
Tipos
Hay básicamente tres procesos diferentes en los que el cobre puede ser electrodepositado sobre otra pieza metálica, y estos hacen referencia específicamente a la solución electrolítica en la que se sumergen los componentes de la celda.
Cobreado en medio ácido
El cobreado ácido es uno de los tipos más comunes de cobreado utilizado. La solución electrolítica suele estar constituida de sulfato de cobre y ácido sulfúrico, la sal proporciona los iones de cobre mientras que el ácido sirve para mejorar la conductividad del medio, favorecer la corrosión del ánodo y evitar la formación y precipitación de otras sales de cobre[2]. Las reacciones implicadas en el proceso de cobreado ácido son sulfato cobre (II) se describen de la forma siguiente.
El sulfato cúprico se disocia en el baño:
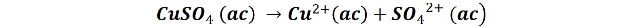
Luego el cobre se oxida de Cu0 a Cu2+ en el ánodo:
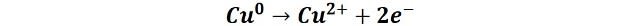
Estos iones cobre se desplazan en la solución para llegar al cátodo, donde reciben nuevamente dos electrones y se reducen a su forma metálica, quedando depositados en la superficie.
Cobreado en medio alcalino (cianurado)
Esta es quizás la más popular de las técnicas de electrodeposición del cobre, se utiliza más a menudo para depositar una capa fina y lisa que cubra la superficie del metal en un metal activo antes de otros procesos de revestimiento adicionales[3]. Este tipo de baños contiene el cobre formando complejos cianurados, específicamente como cianuro de cobre, también contiene hidróxido de sodio para proveer el medio alcalino. No hace falta mencionar que la principal desventaja es que el cianuro es un material peligroso y no debe ser utilizado a la ligera. Algunos de los complejos más usados se disocian de la siguiente forma para producir los iones cobre:
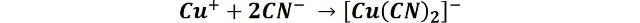
Usos más comunes del cobreado
- Decorativo: El cobreado es bastante empleado como un acabado decorativo por su atractiva apariencia metálica color rojizo.
- Resistencia a la corrosión: El revestimiento de cobre es muy utilizado para aumentar la resistencia a la corrosión en piezas de diferente índole, como partes de automóviles, motocicletas y embarcaciones.
- Capa base: El cobreado proporciona un acabado suave y ayuda para la adhesión de otros acabados. Se aplica una fina capa de cobre a un artículo antes de procesos como el niquelado y cromado.
Demostración
Deposición química
Una forma sencilla de demostrar como el cobre se deposita sobre un objeto metálico puede ser dejando una moneda cubierta de cobre junto a un clavo de hierro en un simple baño de jugo de limón, por varias horas.

Materiales para el experimento n°1. Fuente: emiliomoron.
En la siguiente imagen se observa el proceso.

Clavo y moneda de cobre en baño ácido de jugo de limón. Fuente: @emiliomoron.
Como el jugo de limón es un ácido, sirve de solución electrolítica y a la vez ataca la capa de cobre en la moneda y al hierro en el clavo, liberando iones de ambos metales a la solución. Las reacciones implicadas en el proceso son:
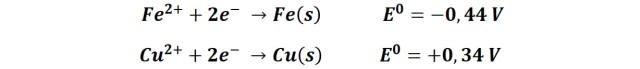
Como hay una diferencia de potenciales se establece un flujo de electrones, y la tendencia según los potenciales establecidos es que el cobre acéptelos electrones, por lo que se establece un par de óxido-reducción donde el cobre se reduce, donde el cobre disuelto se reduce sobre la superficie del clavo, recubriéndolo. En la siguiente imagen podemos observar la capa de cobre depositada sobre el clavo.

Imagen del clavo con una capa de cobre. Fuente: @emiliomoron.
Como se puede observar, espontáneamente se puede depositar una fina capa de cobre sobre el clavo, apenas lo suficiente para hacerse notar después de estar sumergido en el baño por casi 12 horas. Pero lo suficiente para demostrar el proceso.
En este caso llamaríamos a este proceso deposición química, ya que el revestimiento se produce mediante una reacción redox, pero sin la intervención de corriente eléctrica. Podría decirse que es una reacción de naturaleza autocatalítica, ya que después de que las primeras capas de metal se han depositado en la pieza que sirve de sustrato, las subsiguientes capas se producen en la superficie del metal revestido por sí misma.
Electrodeposición
Otra forma para demostrar el recubrimiento de cobre es por la vía electrolítica. Para ello vamos a montar una celda constituida por un recipiente de vidrio donde dispondremos los dos metales que funcionaran como electrodos, los cuales vamos a conectar a una pila de 4.5 V que funcionará como fuente de corriente continua; y los metales para el experimento serán: un trozo de alambre de cobre como ánodo (conectado al terminal positivo) y una llave de latón como cátodo (conectado al terminal negativo). Ambos metales se surgen en una disolución de sulfato de cobre en agua, como solución electrolítica. En el siguiente video podemos observar el proceso.
Fuente: @emiliomoron

Comparación de la llave, antes y después de recibir el baño electrolítico. Fuente: @emiliomoron.
Gracias al procedimiento esta llave, que ya había perdido su baño plateado por la manipulación, recibió una nueva apariencia.
Conclusión y aporte
La electrodeposición del cobre es un proceso de deposición muy importante de la industria metalúrgica para proveer protección ante la corrosión o como acabado intermedio para la deposición de otros metales, además, es el principal proceso de deposición para la producción de placas de circuitos impresos.
Con estos experimentos me he limitado a realizar una demostración de la química del proceso, a escala industrial influyen otras variables en el espesor de la capa de cobre que se puede lograr, espero en el futuro repetir este experimento controlando la cantidad de corriente y el peso de cobre depositado en la pieza. Sin embargo la demostración ofrece a nivel de química básica una forma de realizar una experiencia muy sencilla y didáctica con materiales fáciles de obtener, y que permiten poner en evidencia la química del proceso.
Bueno amigos, hasta aquí el presente post. Espero que les haya gustado la información compartida, y les sirva de orientación para darle una mejor apariencia a algún objeto metálico que haya perdido su protección. Hasta la próxima!
Referencias
- Wikipedia.com. Copper plating.
- Álvarez, A., Chango, G. (2012). Diseño y construcción de una planta piloto para recubrimientos metálicos. Escuela Superior Politécnica de Chimborazo, Ecuador.
- Silchrome.com. 3 Kinds of Copper Plating
- Wikipedia.com. Tabla de potenciales de reducción
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Graciaspor el apoyo amigos!