Baterías de Ni-Cd ¿Cómo funcionan?
Cuando hablamos de las necesidades de pilas en el hogar, sabemos que tenemos un gran consumo de las mismas, utilizamos con mucha frecuencia controles remoto de equipos electrónicos, juguetes infantiles, cámaras digitales y linternas, solo por nombrar algunos. Por este alto consumo de pilas buscamos una solución que evite generar tantos desechos y a la vez ahorrarnos algo de dinero, por ello una de las opciones disponibles en el mercado son las pilas o baterías recargables, siendo un tipo de ellas las de níquel-cadmio.

Ejemplos de baterías recargables de Ni-Cd. Fuente: @emiliomoron.
Las baterías de níquel-cadmio son un tipo de batería recargable que utilizan un cátodo de hidróxido óxido de níquel y un ánodo de cadmio metálico, por eso también la abreviatura de Ni-Cd para describir a este tipo de baterías, derivada de los símbolos químicos del níquel (Ni) y cadmio (Cd) en una configuración que les permite ser recargables, a diferencia de las pilas químicas de zinc-carbono o alcalinas comunes, cuyo cátodo se desgasta a medida que se utiliza la pila.
Las baterías de níquel-cadmio se hicieron muy populares ya que tienen una mayor densidad de potencia y eficiencia que otras baterías recargables precedentes; sin embargo, tienen dos puntos negativos en su reputación, uno es que pueden sufrir efectos de memoria, lo que acorta su vida útil, y el otro es el peligro para el medio ambiente, debido a la toxicidad del cadmio.
Pero para conocer un poco más sobre este tipo de batería tan ampliamente usado, he querido compartir con ustedes algunas de las características de este sistema químico que nos aporta energía eléctrica de forma reutilizable en nuestros equipos electrónicos.
Estructura y evolución
Las baterías de níquel-cadmio de celda húmeda datan de 1899, fue creada por Waldemar Jungner en Suecia, como una alternativa a las baterías de plomo ácido, que para entonces eran la única opción existente en el mercado de batería recargable. Aplicando pequeñas mejoras al prototipo original, rápidamente la densidad de energía aportada aumento significativamente. Aunque Jungner experimentó con la sustitución del cadmio por hierro descubrió que estas formulaciones no eran suficientes. Thomas Edison introdujo un diseño similar en los Estados Unidos cuando patentó una batería de cobalto-cadmio en 1902, luego mejoro el diseño de la batería con una formulación de níquel-hierro. Para 1906 Jungner ya había instalado en Suecia una fábrica para producir batías de Ni-Cd de celda húmeda[1].
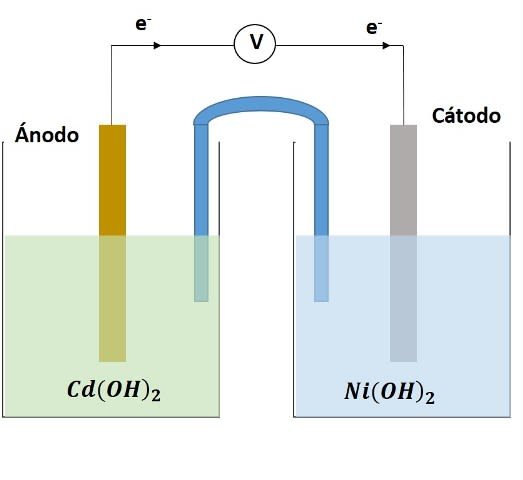
Esquema de funcionamiento de una celda galvánica Ni-Cd. Fuente: @emiliomoron.
Los desarrollos siguientes fueron lentos, pero en 1932 se hicieron avances para depositar los materiales activos dentro de un electrodo poroso niquelado. En 1947 se produjeron más mejoras al absorber los gases generados durante la carga, lo que dio lugar a la moderna batería sellada de NiCd[2]. Para 1950 las baterías de placa sinterizada aparecieron como una gran mejora y se hicieron muy populares, estas se lograron mediante la fusión de polvo de níquel a una temperatura muy por debajo de su punto de fusión utilizando altas presiones, las placas elaboradas de esta forma resultan ser muy porosas, luego, las placas positivas y negativas se producen sumergiendo las placas de níquel en materiales activos de níquel y cadmio, respectivamente. Estas placas permitieron reducir el tamaño de las baterías y aumentar a la vez la superficie por volumen, generando así corrientes más altas.
Básicamente para el día de hoy las baterías de Ni-Cd se fabrican utilizando una configuración de rollo, mediante el cual se incorporan varias capas de material positivo y negativo enrolladas en forma cilíndrica alternada[1].
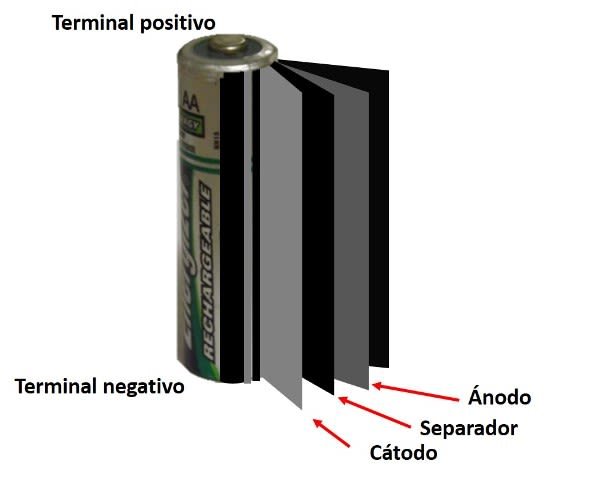
Esquema de la configuración de rollo de una batería de Ni-Cd. Fuente: @emiliomoron.
Durante muchos años, el Ni-Cd fue la opción de batería preferida para radios bidireccionales, equipos médicos de emergencia, cámaras de vídeo profesionales y herramientas eléctricas. A finales de la década de 1980, la capacidad ultra-alta de NiCd impresionó al mundo con capacidades que eran hasta un 60 por ciento más altas que las del Ni-Cd estándar. El empaquetamiento de material más activo en la célula logró esto, pero la ganancia se vio ensombrecida por una mayor resistencia interna y un menor número de ciclos.
¿Cómo funcionan?
Esta batería es una celda electroquímica como las pilas normales, pero sus electrodos están constituidos por una placa positiva de hidróxido óxido de níquel (NiOOH)y una placa negativa de cadmio metálico separados entre sí por una lámina porosa que tiene impregnado una solución acuosa de hidróxido de potasio que funciona como electrolito para facilitar el transporte de carga. Este dispositivo aprovecha las propiedades de ambos metales para proporcionar almacenamiento y posterior suministro de energía eléctrica. Es básicamente el mismo funcionamiento químico de una pila normal; el cadmio (en lugar de zinc) se oxida y pierde electrones mientras que el NiOOH los gana.
En las pilas cilíndricas de los tamaños AAA, AA, C, D y F, el electrodo positivo, el separador y el electrodo negativo se enrollan formando un paquete en espiral, que se ensambla en una caja de acero niquelado. Los contactos eléctricos se sueldan y el electrolito se rellena de acuerdo con el volumen de los poros del electrodo y del separador[3].
En las siguientes ecuaciones, se presentan las reacciones de la batería durante la carga y la descarga.
En el cátodo:
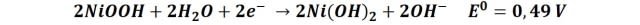
En el ánodo:
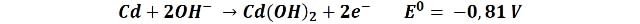
La reacción general se puede escribir como:
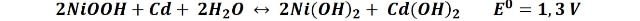
Para el caso de la batería de Ni-Cd, esta reacción química es reversible, lo cual es lo que determina propiamente la propiedad de recargable de esta batería.

Durante la utilización de la batería, es decir, durante la descarga, las reacciones van de izquierda a derecha, y el hidróxido de níquel reacciona con el cadmio metálico. Mientras que durante el ciclo de carga, la reacción se revierte restituyendo ambos componentes, y permitiéndoles volver a entregar la carga en un nuevo ciclo.
El hidróxido de potasio, el electrolito en este tipo de baterías, no forma parte de las reacciones electroquímicas que se producen en el dispositivo, por lo que su concentración prácticamente no varía durante los ciclos de carga y descarga. Lo cual es una ventaja respecto a las baterías de plomo-ácido.
Aplicaciones
Las celdas selladas de Ni-Cd se pueden encontrar en presentación individual o ensamblada en paquetes de baterías que contienen varias celdas. Por lo general las celdas individuales se utilizan para juguetes y equipos electrónicos portátiles.

Varias celdas empacadas. Fuente: @emiliomoron.
Versiones en miniatura, tipo botón, se utilizan en pequeñas lámparas de jardín, memoria de computadora y juguetes.

Batería de reserva de Ni-Cd en una placa de control. Fuente: Wikimedia Commons, CC BY-SA 4.0
Gracias a una resistencia interna relativamente baja y que pueden suministrar altas corrientes de sobretensión, hicieron posible que tuviéramos potentes herramientas eléctricas inalámbricas y divertidos vehículos eléctricos a control remoto.
Baterías especiales de Ni-Cd son utilizadas en equipos de comunicación inalámbricos y lámparas para iluminación de emergencia, baterías de arranque de aviones, vehículos eléctricos.

Batería Ni-Cd de avión. Fuente: Wikimedia.commons, CC-BY-SA-4.0
Impacto ambiental
Aunque muy versátiles, el problema de estas baterías es que una vez gastadas se convierten en un residuo peligroso. En la mayoría de los casos, se desechan como un residuo domestico común, siguiendo el curso habitual de la basura, es decir, dispuestas en vertederos directamente en el suelo, incineradas o en el peor de los casos, llegan a los cuerpos de agua por un mal manejo de los desechos sólidos. Y una vez que la cubierta de metal se corroe, comienza a filtrar los compuestos de estos metales, los cuales tienen efectos nocivos para el ambiente, especialmente el cadmio, que es un metal pesado extremadamente tóxico y un conocido cancerígeno humano.

Batería Ni-Cd con un pictograma de reciclaje. Fuente: Wikimedia Commons, CC0
Conclusión y aporte
Las baterías de Ni-Cd siguen siendo una de las baterías más resistentes y tolerantes, a pesar de que han perdido terreno en el campo de las baterías recargables para usos domésticos frente a las baterías de níquel-hidruro metálico o las de iones de litio más recientes, sin embargo, para el uso industrial las grandes baterías ventiladas aún son las predilectas para los sistemas de reserva de energía y energía motriz, siendo la aviación aún fiel a este sistema. Pero tienen el consigo el problema del cadmio, por lo que su uso debe llevar asociada la propuesta para su apropiado reciclaje.
En el post se presentan las ecuaciones químicas que permiten el funcionamiento de esta tecnología, por lo que su discusión es una forma didáctica de acercar a los interesados a las aplicaciones prácticas que tienen las ecuaciones de óxido-reducción en actividades cotidianas. Por otro lado, también sirve para concientizar al lector sobre la disposición final adecuada que deben tener este tipo de baterías por su relación con un metal toxico.
Bueno amigos, es todo por los momentos, muchas gracias por leer el post espero les haya gustado. ¡Hasta el próximo!
Referencias
- Qwe.wiki.com. Batería de níquel-cadmio
- Batteryuniversity.com. Nickel-based bateries
- P. Kurzweil, J. Garche (2017). Overview of batteries for future automobiles. Lead-Acid Batteries for Future Automobiles.
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Thanks for using the STEMsocial app and including @stemsocial as a beneficiary, which give you stronger support.
Muchas gracias por el apoyo amigos!!
Saludos! Muy didáctico el contenido mostrando las reacciones involucradas. ¿El envoltorio plástico se utiliza para evitar que las pilas sean extraídas del aparato? Me parece haber visto pilas similares en una raqueta anti-zancudos.
Saludos amigo @acont, gracias por apreciar el contenido. En el caso de varias celdas empaquetadas supongo que el envoltorio plástico es la mejor manera de mantenerlas agrupadas y mantener el circuito unido. No he visto como estan incorporadas en ese aparato, pero esta forma es la más común de encontrarlas en los equipos electronicos.
Interesante, gracias por la respuesta, saludos.
https://twitter.com/EspanolStem/status/1308822712777834497
https://twitter.com/EspanolStem/status/1308822795330023424
Muy interesante la información sobre estas pilas y sobre todo la importancia de manejar bien los desechos ya que sus componentes son toxicos. Saludos
Muchas gracias @popurri. Me alegra que encontraras interesante la información, y si, es muy importante conocer que tienen componentes muy toxicos. Saludos!