Disociación del agua // Water dissociation (ESP-ENG)
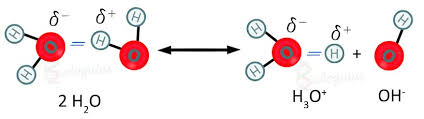
El agua como electrolito débil que es, se disocia en muy escasa proporción según la siguiente reacción:
Water as a weak electrolyte that it is, dissociates in a very small proportion according to the following reaction:
H2O + H2O ↔ H30+ + OH-
Por su especial estructura H-O-H, origina el mismo catión que todos los ácidos, H3O+ o H+; y el mismo anión en las bases OH-. Y así es comprable a todas las sustancias que pueden liberar los dos tipos iones del disolvente y se llaman anfóteras o anfolitos. La nomenclatura del equilibrio suele simplificarse sustituyendo el ion hidronio H3O+ por el protón H+.
Due to its special H-O-H structure, it originates the same cation as all acids, H 3 O + or H + ; and the same anion in the OH- bases. And so it is comparable to all substances that can release both types of solvent ions and are called amphoteric or ampholytes. The equilibrium nomenclature is usually simplified by substituting the hydronium ion H 3 O + for the proton H + .
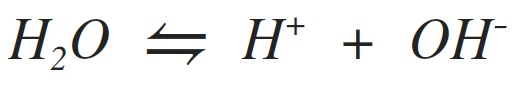
Pero como el protón solo existe durante pequeños intervalos de tiempo en tubos de alto vacio, se prefiere en lo posible formular con el ion hidronio que es el que se encuentra en todas las disoluciones fisiológicas.
El equilibrio de disociación del agua está muy desplazado hacia la izquierda es decir las concentraciones de iones en el agua pura son mínimas. Las concentraciones de los iones H3O+ y OH- se han podido determinar con facilidad a cualquier temperatura, conocidas las conductividades de ambos iones, por medio de las medidas de conductividad del agua.
But since the proton only exists for short periods of time in high-vacuum tubes, it is preferred where possible to formulate with the hydronium ion, which is the one found in all physiological solutions.
The dissociation equilibrium of water is highly displaced to the left, that is, the ion concentrations in pure water are minimal. The concentrations of the ions H 3 O + and OH - have been easily determined at any temperature, knowing the conductivities of both ions, through water conductivity measurements.