LAS LÍNEAS DEL ESPECTRO ATÓMICO Y LAS LUCES FLUORESCENTES

Autor: @madridbg, a través de Power Point 2010, utilizando imágenes de dominio público.
Bienvenidos estimado lectores de la plataforma #hive, sirva la presente publicación como abordaje de los principios químicos detrás de las líneas de emisión del espectro atómico y como pueden utilizarse las misma en la emisión o producción de energía en forma lumínica. Como ha sido constante este tipo de contenido de rigor científico bajo una modalidad flexible, la compartiremos a través de la comunidad de @cervantes quienes se han mantenido a la vanguardia en los tópicos con aportaciones académicas.
En este sentido, debemos recordar que el principio de organización químico se centra bajo las reglas o propiedades periódicas, donde podemos encontrar y conocer el conjunto de cualidades que exhiben los elementos presentes en nuestro entorno, además de utilizarse como un patrón que nos permite tener una visión amplia de la clasificación de los elementos en la naturaleza y su comportamiento frente a otras sustancias de composición invariable.
Fig. 2. Tabla periódica de los elementos químicos. Salvador85
Por consiguiente, para poder hablar de espectro atómico se hace necesario instruir al lector, sobre la energía electromagnética que se obtiene a partir de los átomos y que en la actualidad, podemos clasificar como energía infrarroja, microondas, luz visible, entre otros. Aunque muchos quizás piensan que son diferentes, todas entran en la categoría de radiación electromagnética, las diferencia entre ella se atribuye a la longitud de ondas y frecuencia en las que se mueven, la cual les confiere mayor o menor energía.
De tal manera, la energía electromagnética se concatena con las líneas de absorción atómica, ya que los átomos emiten radiación en forma de luz cuando pasan de un estado de excitación elevado a uno más bajo, esta radiación aporta información valiosa sobre la constitución atómica.
Un ejemplo de lo anterior, lo representa la energía lumínica procedente del sol, las cuales en primera instancia podemos pensar que es solo luz blanca, pero si la hacemos pasar a través de un prisma, podemos observar que se descompone en las longitudes que las forman, lo que genera la observación de un conjunto de colores sobre el prisma que podemos percibir mediante nuestros ojos.
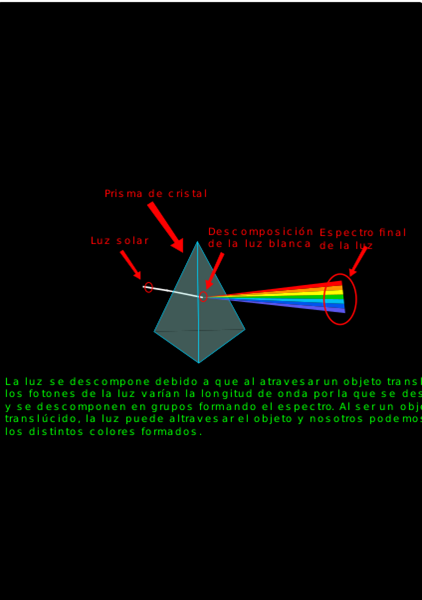
Fig. 3. Descomposición de la luz. RodriguezBellidoFernando
De tal manera y en opinión de Mcmurry (2008),
“Si hacemos pasar un átomo por una rejilla angosta, podemos observar la emisión de líneas sobre un fondo oscuro, proceso que se conoce como espectro de líneas y en consecuencia cada átomo emite líneas de colores diferentes, por ejemplo en cloruro de sodio cuando se calienta emite una colocación amarilla, el hidrógeno una colocación azul y así cada átomo de la tabla periódica.”
Un ejemplo de este sorprendente fenómeno, lo podemos percibir en los fuegos artificiales, la variedad de colores que observamos se debe a la mezcla de metales presentes, los mismos al ser calentados por la pólvora se excitan y emiten energía lumínica procedente de las líneas de absorción atómica. Este comportamiento es particular de cada átomo, por lo que se asume como la firma espectral del mismo.

Fig. 4. Cada color de los fuegos artificiales representan un elemento presente es estos. pixnio
Ahora bien, extrapolando lo previamente estudiado, nos damos cuenta que los focos fluorescentes actúan bajo dicho fundamento, los mismos son en esencia una representación del tubo catódico a una micro-escala, están constituido por un tubo de vidrio lleno de argón que contiene vapor de mercurio en pequeña concentración, por otra parte el dispositivo consta de un balastro electrónico que es la responsables de emitir corriente de alto voltaje de forma controlada.
El funcionamiento del dispositivo consiste el calentar el filamento mediante la corriente, lo que produce el desprendimiento de electrones que al entrar en contacto con los átomos de mercurio presentes, les confiere una elevada energía cinética, provocando que estos se exciten, al volver a su estado basal o normal se produce la liberación de fotones en forma de energía luminosa, de acuerdo a las líneas del espectro atómico.
Debemos tomar en cuenta que la mayor parte de las emisiones del mercurio es en forma de energía ultravioleta no visible para nosotros y para compensar esta deficiencia al dispositivo se le agrega fósforo el cual transforma las ondas ultravioleta en energía en forma de luz visible
De esta forma las bombillas fluorescente son 20% más eficiente que las bombillas incandescentes normales que todos conocemos, donde solo se aprovecha el 5% de la energía en forma de luz y el resto se desperdicia en forma de calor.

Fig. 5. El color de las bombillas fluorescente va en función del tipo de fosforo que se utilice para transformas la radiación ultravioleta generada. zain ali
Por consiguiente, el conocimiento y aplicabilidad de los fundamentos químicos nos permiten el desarrollo de equipos que nos hace más fácil nuestra calidad de vida, de tal manera que si te ha parecido oportuna esta publicación te invito a dejar tu aporte en la sección de comentarios.
BIBLIOGRAFÍA CONSULTADA
[1] Chang, R. (2010). Química. Decima edición. McGraw-hill Interamericana editores. ISBN: 978-607-15-0307-7.
[2] McMURRY E., John y Fay C., Robert. (2008). Química general. Quinta edición PEARSON EDUCACIÓN, México, 2009 ISBN: 978-970-26 1286-5.
[3] Ralph, H. Petrucci, William S. Harwood, E. Geoffrey Herring. (2003). QUIMICA GENERAL. Octava edición. PEARSON EDUCACIÓN. S.A., Madrid.
[4] WADE,LEROY. (2011). . QUÍMICA ORGÁNICA. VOLUMEN 2. SÉPTIMA EDICIÓN. PEARSON EDUCACIÓN, MÉXICO, 2011 ISBN: 978-607-32.()793•5. ÁREA: CIENCIAS
DE INTERÉS
Para más información relacionada con las áreas de ciencia, tecnología, ingeniería y matemáticas, no dudes en visitar #stemsocial y #stem-espanol, son comunidades que promueven avances científicos en estas áreas

0
0
0.000
https://twitter.com/BGMadrid/status/1371966924406538242
#posh twitter:
https://twitter.com/BGMadrid/status/1371966924406538242?s=20
Su post ha sido valorado por @ramonycajal
Gracias @ramonycajal por tu apoyo y valoración en cada una de mis publicaciones para la comunidad