Neuer Katalysator kann CO2 und CO in H20 umwandeln!
Liebe Umweltschützer und -verschmutzer!
Eine Möglichkeit, den CO2-Anteil der Atmosphäre zu kontrollieren ist, es gar nicht entstehen zu lassen. Das ist aber verbunden mit einer massiven Einschränkung unseres Lebensstils und mit einem massiven Verlust an Arbeitsplätzen und generell Wohlstandsverlust. Eine andere ist es, im Umfang des freigesetzten CO2 eine adäquate Menge zu binden durch Aufforstung, Ozeandüngung (1) und andere Negativemissionstechnologien, die aber ihrerseits teils unbekannte globale Umweltauswirkungen haben. Die bevorzugte Option wäre daher, das entstandene CO2 einzufangen oder falls das nicht gelingt, es in etwas anderes umzuwandeln und nutzbar zu machen (CO2 utilization). Ein grundsätzlicher Ansatz besteht darin, spezielle Katalysatoren zu verwenden, die solche Reaktionen ermöglichen. Das Problem: Die mangelnde Stabilität - nach gewisser Zeit verlieren viele Materialien ihre katalytischen Eigenschaften, ähnlich wie ein Filter irgendwann verstopft und ausgetauscht werden muss.
Das Institut für Materialchemie der TU Wien rund um Prof. Christoph Rameshan forscht dazu an Perowskiten (2) als Katalysatormaterial, allseits beliebte und leicht herstellbare Mineralien mit vielfältigen Anwendungsmöglichkeiten. Die werden bislang eher für Photovoltaik-Elemente oder aufgrund ihrer Supraleitfähigkeit als elektronische Bauteile eingesetzt. Nun gelang es gemäß dieser Arbeit erstmals, einen Perowskit herzustellen, der sich offenbar als Katalysator gut eignet, um CO2 in andere Substanzen umzuwandeln, z.B. in synthetische Treibstoffe.
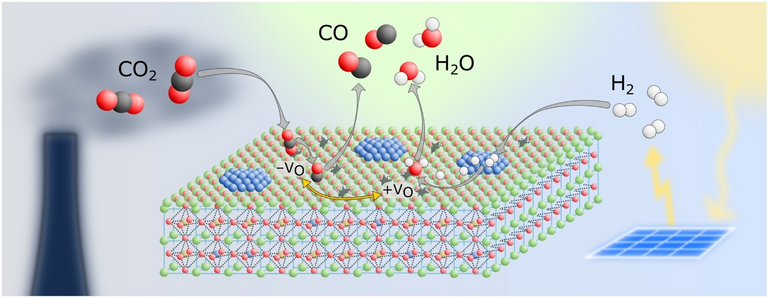
Die Reaktion im Katalysator: Aus CO2 und H2 wird CO und H2O
Quelle
Diese Reaktion nennt sich "reverse Wassergas-Shift-Reaktion“ (rWGS) und ist an sich ein alter Hut. Da sie hohe Temperaturen erfordert, gingen die nötigen Katalysatoren bisher rasch kaputt, was das Ganze unrentabel machte. Die Gruppe von Christoph Rameshan probierte verschiedene Perowskite aus und fand schliesslich eine Kombination aus Kobalt, Eisen, Calcium und Neodym, die sehr gut funktionierte (3).
Bei der Katalyse bilden sich an der Oberfläche der Perowskit-Kristallstruktur sogenannte "Sauerstoff-Fehlstellen" – Stellen, an denen eigentlich ein Sauerstoff-Atom sitzen sollte, an denen aber CO2-Moleküle andocken können, um dann in Sauerstoff und Kohlenmonoxid zerlegt zu werden.
Der Perowskit-Katalysator ist nicht nur stabiler als andere, sondern auch regenerierbar. Wenn seine katalytische Aktivität irgendwann doch nachlässt, kann er mit Hilfe von Sauerstoff wieder in seinen ursprünglichen Zustand versetzt werden. Das macht ihn Schätzungen zufolge ökonomisch vielversprechend, obwohl er dreimal so teuer ist als andere Katalysatoren. Derzeit versucht die Arbeitsgruppe, das relativ teure Neodym durch etwas anderes zu ersetzen, um ihn noch rentabler zu machen.
Theoretisch könnte man damit CO2 aus der Atmosphäre holen. Weil man aber dafür zuerst das Kohlendioxid konzentrieren muss (was nur mit hohem Energieaufwand möglich ist), wäre es effizienter, CO2 dort umzuwandeln, wo es in großer Menge entsteht, beispielsweise in Industrieanlagen. Wenn man solche Anlagen mit derartigen CO2-Wandlern ausstattet, kann das erzeugte Kohlenmonoxid (CO) effizient zu chemischen Grundstoffen wie Methanol und auch zu synthetischem Treibstoff verarbeitet werden, ohne dass diese Fabriken CO2-Schleudern wären (3). Eine neue Art grüner Treibstoff ohne Abhängigkeit von Wind und Sonneneinstrahlung wäre so möglich.
Warum ich das alles erwähne? Weil es ein gutes Beispiel ist für die Kraft der Innovation. Die derzeitige Politik denkt nur in Begriffen wie Regulierungen, Verbote und Kontrollen, statt auf die Kreativität der Wissenschaft zu setzen!
Quellen:
(1) https://wiki.bildungsserver.de/klimawandel/index.php/Ozeand%C3%BCngung
(2) https://www.perovskite-info.com/
(3) https://www.scinexx.de/businessnews/neuer-katalysator-fuer-geringeren-co2-ausstoss/
Yay! 🤗
Your post has been boosted with Ecency Points, by @stayoutoftherz.
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for Proposal
Delegate HP and earn more
Servus @stayoutoftherz,
das man von Autoabgasen gewonnene Wasser trinken kann gibt es ja schon sehr sehr lange,
VW hatte dies mal auf der IAA Vorgestellt aber auch die TU Wien und TU Graz.
Zu deiner Vermutung:
Auch das gibt es bereits! In der Schweiz gibt e ein Startup die ein ganzes Dorf dort CO2 frei macht.
https://climeworks.com/
Es gibt bereits Unzählige Berichte und Dokumentationen darüber...
hier zB.:
https://www.mdr.de/wissen/entfernung-kohlenstoff-cozwei-luft-atmosphaere-dac-schon-effizient-moeglich-100.html
Ansonsten climeworks eingeben...
lg 🤠
Ich weiß nicht, diese riesigen Dinger verschandeln die Umwelt und das CO2 wird ja nicht umgewandelt, sondern abfiltriert und in den Boden gepumpt, quasi unter den Teppich gekehrt. Erscheint mir nicht sehr nachhaltig zu sein. Innovativ ist anders (für mich).
Coole Idee
Und Rohstoffe sparen und die Umwelt schon da bin ich auf jeden Fall dabei.
Dann hoffen wir alle mal das CO2 wirklich unser Problem ist und nicht was anderes. Weil sonst setzen wir aufs falsche Pferd
Stimmt, davon ganz abgesehen. Aber das in Frage zu stellen ist wie gegen Windmühlen zu kämpfen.
Pferd & Windmühlen klingt so nach Don Quijote. Da gefällt mir die nachfolgende Methode besser:
Unser Problem ist das Gas in den hohlen Birnen, nicht das in der Luft.
Jetzt wird endlich ein Schuh daraus. Ich dachte immer in den Birnen ist ein Vakuum🙃
Guter Einwand. Monokausale Ursachen für planetarische Problem-Nennungen sind immer heikel, wie ich finde.
Nur keine Angst. E-Fuels (nicht dass wir die wirklich bräuchten) kommen ins Rollen, sobald die vollverblödete deutsche Autoindustrie ihre gesamte Produktion von hocheffizienter Dieseltechnologie auf Sackgassen-Elektro umgestellt hat...
Ich kann bis heute nicht verstehen, dass sich eine reiche und mächtige Industrie mit millionenschweren Werbebudgets von diesen notgrünen Politclowns bis zur völligen Selbstaufgabe auf der Nase rumtanzen lässt. Ich würde das Gesocks medial so fertigmachen, die wüssten nicht mehr, wo unten und oben ist!
Wir könnten in Ruhe in paradiesischen Zuständen leben, wenn das Erreichte verteidigt und darauf aufgebaut würde, und die...
...nicht längst weitestgehend durch die "richtige" Haltung ersetzt worden wäre.
Sorry, es ist einfach nur noch zum Kotzen!
Genau so ist es, Firmen wie VW und Volvo (leider) haben sich komplett der E-Mobilität verschrieben - ohne Not, in vorauseilendem Gehorsam. Komplett irre.
Die Not war schon da, mit immer engeren Grenzwerten für ein harmloses ATEMGAS! Anstatt sich sofort massiv dagegen zu wehren, haben sie gedacht, sie könnten das mit Softwaretricksereien überspielen. Naja, es ist, was es ist. Komplett bekloppt eben.
PS: Ich hoffe mittlerweile, dass Baerbock Kanzlerin wird, der Sprit dann 5 Euro kostet und Strom zum Luxusgut wird! Der Michel muss endlich mal richtig bestraft werden, wegen des nötigen Lerneffekts. Ja, mittlerweile bin ich gehässig geworden. Es reicht!
Kann ich verstehen. Solange die Temperatur nur langsam gesteigert wird, begreift es der Frosch nicht. Mit den Grünen als Kanzlerpartei wird die Temperatur im Kessel sprunghaft ansteigen, da merken die Schlaffrösche dann vielleicht, was Sache ist. Aber dann wird es vielleicht auch schon zu spät sein...
"Warum ich das alles erwähne? Weil es ein gutes Beispiel ist für die Kraft der Innovation. Die derzeitige Politik denkt nur in Begriffen wie Regulierungen, Verbote und Kontrollen, statt auf die Kreativität der Wissenschaft zu setzen!"
Da bin i9ch ganz bei Dir!
Liebe Grüße Michael
!invest_vote
!jeenger
@mima2606 denkt du hast ein Vote durch @investinthefutur verdient!
@mima2606 thinks you have earned a vote of @investinthefutur !
Your contribution was curated manually by @mima2606
Keep up the good work!
Das Neodym zu ersetzen wäre sehr wichtig, da Neodym ein seltenes Element ist das nur unter sehr aufwendigen und umweltschädlichen Verfahren gewonnen werden kann. Neodym wird auch für den Bau von Windrädern gebraucht. Vielleicht könnte man es ja von dort wegnehmen.
Das liegt vor allem daran weil der Politik nichts daran gelegen ist jegliches Problem zu lösen. Sonst könnten die ja nicht so tun als ob sie nützlich wären.
Stimmt, ganz im Gegenteil: Sie schaffen erst die Probleme, für die sie dann Lösungen anbieten, wenn man sie wählt!
Ginge es wirklich um CO2 wäre das sicher eine Lösung.
Tut es aber nicht.
CO2 ist nur ein Mittel zum Zweck...
Ja, eine heilige Kuh und Monstranz der Klimajünger.
Als Fan von Nachhaltigkeit und gleichzeitig ein Freund der Wirtschaft, kann ich dem absolut nichts hinzufügen. So wenig wie ich an der Zielsetzung der Fridays zweifel, desto mehr befremdet es mich, dass man glaubt durch Verbote und einer Senkung der Lebensqualität auch nur irgend eine Chance zu haben. Irgendwann brechen ggf. die radikalen Gegenkräfte durch und machen das Problem noch schlimmer.
Der einzige Weg dort heraus kann Wissenschaft sein und eine Umsetzung durch Wirtschaft. Nur eine geschickte Lösung, die gleichzeitig günstig ist, wird eine echte Lösung sein. Wer wirklich eine saubere Umwelt will sollte endlich begreifen, dass Wirtschaft dabei nicht der Feind ist.
Meine Feststellung im Lauf der Jahre, bei denen ich mich immer erst über Innovationen, die zum Umweltschutz beitrugen, sehr begeisterte, schlug in Enttäuschung um, wenn ich über mehrere Tage, Wochen, recherchiert hatte und nach echten Praxis-Beispielen und langfristigen Beobachtungen der positiven Auswirkungen von neuen Technologien geschaut habe. Die meisten sind schöne PR-Projekte, mehr im Internet als in der wirklichen Welt zu finden. Schnell umgesetzt, viel Geld verdient, oft schnell wieder verschwunden bis zum nächsten profitablen Ding. Ich bin mittlerweile allem gegenüber skeptisch. Auch den Neuerungen aus der Wissenschaft zum Umweltschutz. Die wird hier wie anderswo genauso missbraucht.
Meine Sichtweise ist die: es wird keine einzige gute umweltschonende Technologie geben, die etwas verändern wird, wenn wir unseren Lebensstil nicht gleichzeitig ändern. Ich gehe hier mit dem Ökonom Niko Paech, der eine Subsidenz-Wirtschaft vorschlägt, bei der das Leben des einzelnen aus Selbstversorgung, einer Reparatur-Ökonomie und einem Brot-Job besteht (simpel ausgedrückt eine Art 3-teiliger Arbeitstag).
Warum wir beispielsweise auf den Grundstücken der vielen Einfamilienhäuser keine Nutzpflanzen anbauen oder sogar Kleintiere züchten, ist ökologischer Irrsinn. Hier, wo ich aufwuchs, gab es in meiner Kindheit noch viele Nutzgärten, wo wir durchaus bemerkenswerte Ernten jedes Jahr hatten mit so viel Überschuss, dass wir es an die Nachbarn verschenkten. Was im Frühjahr und Sommer geerntet wurde, wurde dann zum Teil für den Winter eingekocht oder anderweitig konserviert.
Der Aspekt der Selbstversorgung wird regelmäßig in unseren von Technologie verwöhnten Gehirnen ausgeblendet. Aber ohne eine anteilige Versorgung mit Nahrungsmitteln kann keine teilweise Unabhängigkeit von der Fremd-Ernährung und Fremdversorgung entstehen.
Das ist so, als würde der Buschmann, der einen Teil des Lebens mit Jagen und Sammeln verbringt, sagen, dass er darauf verzichtet und daran glaubt, dass die Götter ihm einen Aparatschik hinstellen, der das fortan für ihn erledigt. ;-)
hätte nicht gedacht das sowas möglich ist, das könnte ja möglicherweise noch der Elektro-Branche Konkurrenz machen 😁