Propiedades coligativas. Estudio de la disminución del punto de congelación
Hola amigos
En esta oportunidad quiero comenzar a compartir información relacionada con las propiedades coligativas de las soluciones, ya que tienen gran utilidad en la vida diaria, por lo que resulta interesante conocer los fundamentos que las sustentan.
Estas propiedades se caracterizan por depender sólo del número de partículas del soluto presente en la disolución y no en la naturaleza de sus partículas. Entre ellas se conocen la disminución de la presión de vapor, presión osmótica, aumento del punto de ebullición y disminución del punto de congelación.
En este post comenzaré a desarrollar información relacionada específicamente con la disminución del punto de congelación, les invito a leer.

Fuente: Imagen realizada en power point con imagen de dominio público wikipedia.org
En algunas regiones donde las temperaturas se ubican por debajo de los 0°C se observa la presencia de nieve y hielo en grandes cantidades, lo que dificulta llevar a cabo las actividades diarias y puede también generar situaciones peligrosas, especialmente en la circulación de los automóviles, ya que pueden llegar a deslizarse y sufrir accidentes.
Frente a esta situación se han tomado algunas medidas para contrarrestar estos efectos. Una de estas medidas consiste en adicionar sal en las carreteras.
Ahora bien, ¿por qué se adiciona este compuesto? ¿Cómo puede ayudar? ¿Qué efecto ocasiona?
Generalmente se adiciona cloruro de sodio (NaCl), ya que este compuesto es más económico y se consigue fácilmente en comparación con otras alternativas más costosas como sales de calcio y magnesio. La sal de cloruro de calcio presenta la ventaja que al disolverse libera calor, que ayuda a fundir más el hielo, sirviendo todas estas sales como anticongelantes.
En el caso de los aviones por ejemplo, para eliminar el hielo se emplea el etilenglicol.

Fuente:wikipedia.org
¿Cómo puede ayudar? Para responder esta pregunta, nos podemos basar en la propiedad coligativa que se conoce como disminución del punto de congelación o el descenso crioscópico.
Comencemos por describir los fundamentos de esta propiedad.
La congelación implica el paso de un estado desordenado a un estado ordenado, por lo que el sistema debe liberar energía. Si se compara el disolvente puro con la disolución, se deduce que en la disolución existe mayor desorden, por lo que se debe liberar mayor cantidad de energía para lograr la congelación que en el disolvente puro[2].
Debido a esto la disolución posee un menor punto de congelación que el disolvente puro.
En la siguiente figura que representa el diagrama de fases de una disolución se observa que si se parte desde un punto a hasta el punto b como se observa en la línea punteada azul, disminuyendo la temperatura de la disolución se congelará parcialmente a una temperatura ubicada por debajo de 0 °C, correspondiente a la temperatura de congelación del agua pura.
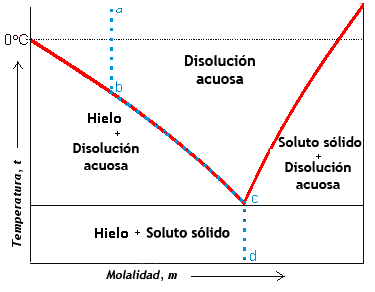
Diagrama de una disolución acuosa. Fuente: Wikipedia.org
A partir del punto b, la temperatura de congelación de la disolución sigue disminuyendo a medida que se incrementa la concentración. La congelación que ocurre es parcial, esto debido a que se congela primero solo parte del agua, quedando otra sin congelar donde se concentra el soluto.
A medida que se concentra el soluto se produce un descenso crioscópico adicional en la parte no congelada y si la temperatura sigue bajando volverá a congelarse parcialmente, repitiéndose este proceso de congelación parcial-concentración-descenso crioscópico adicional a lo largo de la curva b-c, hasta llegar al c, donde el incremento de concentración del soluto ya no produce nuevo descenso crioscópico y solidifica la disolución [1].
La disminución del punto de congelación ∆Tf viene dada por el punto de congelación del disolvente puro T°f menos el punto de congelación de la disolución Tf y su expresión es:
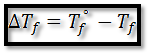
Esta variación es proporcional a la concentración de la disolución:
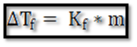
Siendo m la concentración de la disolución en unidades de molalidad y Kf la constante molal de la disminución del punto de congelación en unidades de °C/m.
En la siguiente figura se muestran los valores de la constante Kf de varios disolventes.
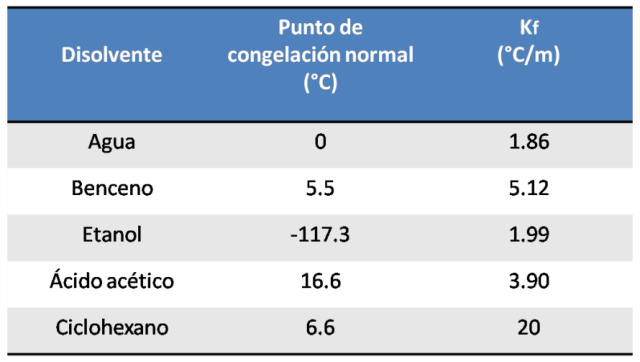
Datos tomados Chang, R. (2002)
De allí se explica entonces lo que ocurre al adicionar sal en las carreteras, provocando una disminución del punto de congelación, logrando que se derrita el hielo y despejando el camino.
El agua se congela a 0°C, sin embargo, una disolución de agua con 10% sal por ejemplo, se congela a -6°C . Es decir, que al aumentar la cantidad de soluto, es necesario más frío para que congele.
Por otra parte, cabe destacar que el hecho de adicionar sal así como resuelve esta problemática, también trae algunas desventajas y riesgos para el ambiente, especialmente en el agua potable.
Hay que tomar en cuenta que el cloruro de sodio es una sal soluble que se disocia en iones sodio y cloruro
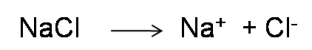
Por lo que al disolverse en el agua se distribuyen en el terreno y son absorbidos por las plantas, pueden llegar a distintos cuerpos de agua y ser consumido por otros animales. En este sentido, se están realizando estudios para conocer el impacto que ocasiona la adición de sal en la carretera sobre los ecosistemas de agua dulce y en el suministro de agua de manera tal que se busquen formas de reducir el uso de descongelantes sin poner en riesgo la seguridad pública[4].
Aplicaciones
La disminución del punto de congelación a nivel industrial y en laboratorio se emplea para determinar la masa molar de distintos productos químicos.
Veamos un ejemplo de la determinación de la masa molar de un compuesto.
Cálculos
Una disolución de 0.650g de un sólido orgánico en 27.8g del disolvente bifenilo tuvo una disminución del punto de congelación de 1.56°C. La constante molal para el bifenilo es 8.00°C/m, con estos datos determinar su masa molar.
En este caso se trabaja a partir de la siguiente ecuación:
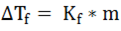
De aquí, se despeja y se calcula la molalidad que está relacionada con los moles del soluto.
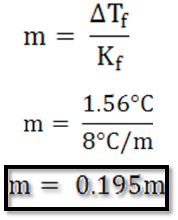
A partir de la molalidad se determina los moles del soluto

Finalmente, con los moles del soluto se determina la masa molar del compuesto

Por otra parte, la disminución del punto de congelación se emplea también para determinar la calidad de los líquidos, siendo este una medida de la cantidad de impurezas que contiene, determinar la adulteración de la leche, ya que puede contener mas agua de lo que visualmente se pueda apreciar, y al estar más diluida disminuye la concentración del soluto y aumenta la temperatura de congelación entre muchas otras aplicaciones en diversas áreas.
Como vemos, resulta muy interesante conocer los fundamentos de las propiedades coligativas de las soluciones lo que permite entender algunos procesos y situaciones cotidianas.
¡Gracias por leer!
Referencias
- Descenso crioscópico. wikipedia.org
- Chang R., y College W. (2002) Química. 7ma edición. McGraw-Hill
- ¿Es bueno echar sal en las carreteras?. Ambientum. Noviembre 2018.
- Stimpson A., (2022)¿Por qué la sal que se echa en el asfalto cuando hay nieve es mala para el agua y el medio ambiente?
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.