Estudio de la influencia de la formación de complejos en la solubilidad de los precipitados
¡Hola amigos!

Fuente: @yusvelasquez
Empecemos por definir un complejo, como un compuesto que se forma por reacción entre un ion metálico (M) con una especie donadora de electrones conocida como ligando (L) y que debe poseer al menos un par de electrones disponibles para compartir. En este tipo de reacciones participan la mayoría de iones metálicos con ligandos neutros como el H2O, NH3, o con los iones de halogenuros.
La reacción en forma general se puede escribir como
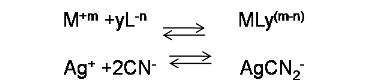
En este caso se tiene por ejemplo el ion Ag+ que reacciona con el ion cianuro para formar el complejo AgCN2-. En este caso el número de coordinación del catión es 2 y corresponde al número de enlaces covalentes que tiende a formar con el ligando. La constante de equilibrio para las reacciones de complejación se conoce como constante de formación (Kf).
Veamos un ejemplo de complejo octaédrico entre el cobalto y el amoníaco.
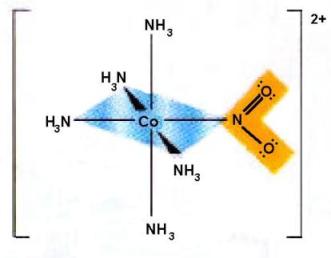
Complejo octaédrico. Fuente: wikimedia.org
En este caso se presenta la disposición espacial de un complejo tetraédrico donde el ion o grupo central se encuentra en medio de un tetraedro regular y los grupos ligandos se ubican en los vértices del mismo.

Fuente: wikipedia.org
Algunos ejemplos se reacciones de formación de complejos y su constante de formación se muestran a continuación

Datos tomados de Atkins, J. (2006)
Estudio cualitativo del efecto de la formación de un complejo en la solubilidad de un precipitado.
Tomemos por ejemplo un precipitado de cloruro de plata (AgCl) que contiene un ion metálico como la plata Ag+ y se añade una base como el amoníaco NH3 como ligando.
Los equilibrios involucrados son los siguientes:

Si se analizan las reacciones mostradas se puede observar que al adicionar amoníaco se produce una reacción con el ion plata disuelto en la solución formando así el complejo Ag(NH3)2+, por lo que basados en el principio de Le Chatelier esto ocasiona que se pierda el equilibrio de la sal al producirse una disminución de Ag+ desplazándose así hacia la derecha con el objetivo de restituir la cantidad que ha sido eliminada aumentando así la solubilidad y por tanto se disuelve mayor cantidad del precipitado.
Estudio cuantitativo del efecto de la formación de un complejo en la solubilidad de un precipitado
- Comencemos calculando la solubilidad molar del cloruro de plata (AgCl) en agua
Para ello, se escribe la reacción de disociación de la sal y su respectivo valor de constante del producto de solubilidad a 25°C según la bibliografía consultada.
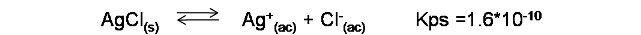
A partir de la expresión de la constante (Kps) se calcula la solubilidad de la sal
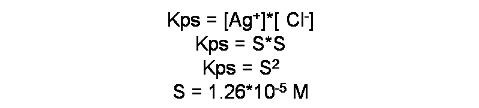
En este caso la solubilidad molar del cloruro de plata es de 1.26*10-5 mol en un litro.
- Calculemos ahora la solubilidad del cloruro de plata en una solución 0.05M de NH3
En este caso las reacciones involucradas son las siguientes:
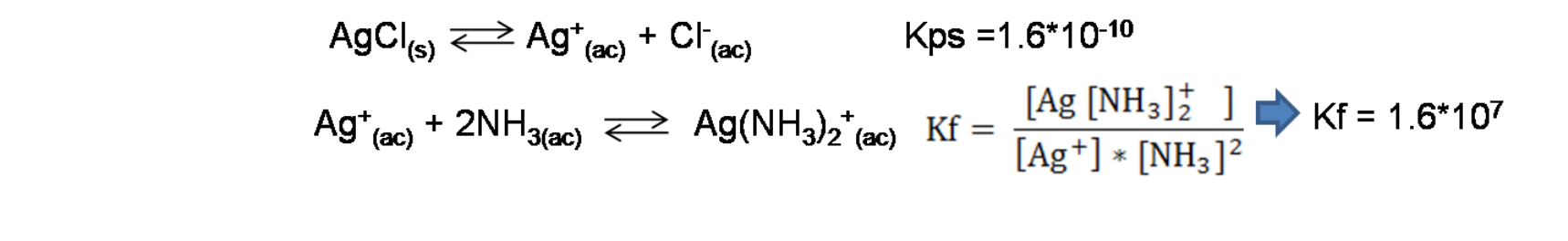
La reacción global viene dada por la suma de ambas reacciones:
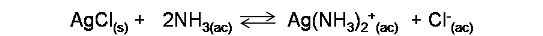
Por lo que la constante de la reacción (K) viene dada por el producto de la constante del equilibrio de solubilidad de la sal (Kps) y la constante de equilibrio de formación del complejo (Kf)
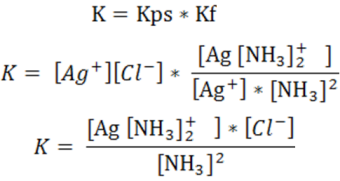
Para el cálculo de las solubilidades correspondientes se puede emplear el cuadro de equilibrio de la siguiente manera

Sustituyendo las concentraciones en la expresión de la constante de la reacción K se tiene la siguiente expresión:
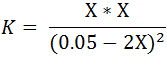
Resolviendo se tiene:
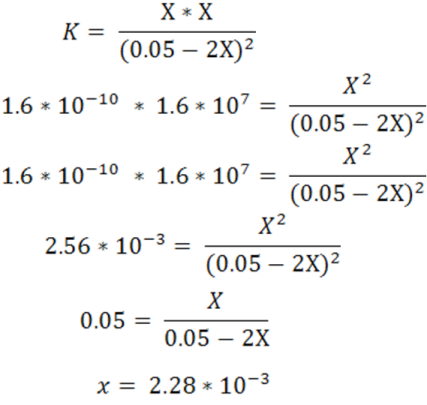
Dado que según la reacción de disociación del AgCl
La solubilidad del AgCl viene dada por la [Cl-]. Si se observa también la ecuación global se tiene que [Cl-] ≈ [Ag(NH3)2+] en la solución saturada.
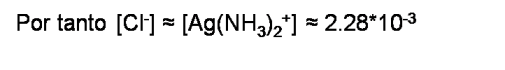
Si se compara la solubilidad del AgCl en agua pura con la solubilidad de AgCl en una solución con NH3 se puede observar que la solubilidad aumenta de 1.26*10-5M a 2.28 *10-3 verificando así la influencia de la formación de un complejo en la solubilidad del precipitado.
Como vemos se puede concluir que la solubilidad de un sal aumenta si puede formar complejos con otras especies presentes en la solución, por lo que resulta importante estudiar que compuesto se pueden emplear como ligandos para lograr el desplazamiento del equilibrio.
Espero que la informacion presentada les sea de gran utilidad, gracias por leer
Referencias
- Skoog, W. (2000). Química Analítica. Mc Graw Hill
- Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
Another chemistry class! Thanks a lot of that
!1UP
You have received a 1UP from @gwajnberg!
@stem-curatorAnd they will bring !PIZZA 🍕
Learn more about our delegation service to earn daily rewards. Join the family on Discord.
PIZZA Holders sent $PIZZA tips in this post's comments:
@curation-cartel(15/20) tipped @yusvelasquez (x1)
You can now send $PIZZA tips in Discord via tip.cc!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for new Proposal
Delegate HP and earn more