Disolución y Dilución. ¿Cómo preparar soluciones?
¡Hola estimados amigos de la comunidad científica de Hive!

¡Empecemos por la disolución!
Por ejemplo, si preparamos un jugo a partir del polvo que viene en un sobre que podemos encontrar en cualquier venta de artículos de comida, la preparación aquí consiste en agregar el sólido en agua, hasta que se disuelva completamente. Entonces, una disolución implica la preparación de una solución cuando se tiene el soluto sólido y este se disuelve en el solvente.

Figura 2. Preparación de una disolución. Fuente: @yusvelasquez
Este es el proceso empleado comúnmente para preparar por ejemplo, soluciones básicas como las de hidróxidos de sodio NaOH. Para ello se calcula el peso requerido de base para preparar una solución a una determinada concentración, se pesa en una balanza analítica, luego se disuelve en agua y se lleva hasta el volumen especificado en el balón aforado.
Cálculos
Ejemplo típico
Preparación de una solución básica de NaOH. Determinación de la cantidad de hidróxido de sodio necesario para preparar 100 ml una solución de NaOH 0,1 mol/L.
En este caso los cálculos se basan en la unidad de concentración Molaridad
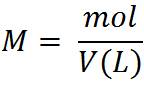
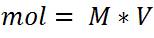
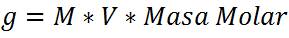
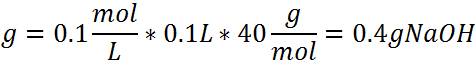
Esto significa que es necesario pesar en la balanza 0,4 gramos de NaOH, disolver y adicionar en un matraz aforado hasta completar los 1000ml y así hemos preparado una solución a una concentración 0,1mol/L.
Dilución
En nuestra vida cotidiana también nos ha sucedido que nos han servido una taza con café al realizar una visita o en algún restaurante, y observamos que es de color muy oscuro y concentrado, algo que para muchos puede resultar un poco desagradable. En estos casos se suele adicionar un poco más de agua caliente o leche según la preferencia.
Básicamente lo que estamos haciendo es una dilución, disminuyendo la concentración del café agregando más disolvente que en este caso puede ser más agua o leche.
Si continuamos con el ejemplo del jugo, podemos adicionar aún más solvente y obtener así una solución más diluida que cualitativamente se puede observar por la coloración, como se muestra.

Figura 3. Dilución de una solución. Fuente: @yusvelasquez
En química es común adquirir y almacenar las soluciones en forma concentradas, estas son llamadas soluciones madre, y a partir de ellas se pueden preparar soluciones a diferentes concentraciones según lo que se requiera mediante la dilución o reducción de la concentración.
Al diluir una solución, permanece el mismo número de moléculas de soluto ocupando un mayor volumen. Por tanto, un mismo volumen contiene un menor número de moléculas que en la solución concentrada. Este proceso lo podemos interpretar observando el siguiente modelo de partículas donde aumenta el número de partículas de solvente y se mantiene el número de partículas de soluto.
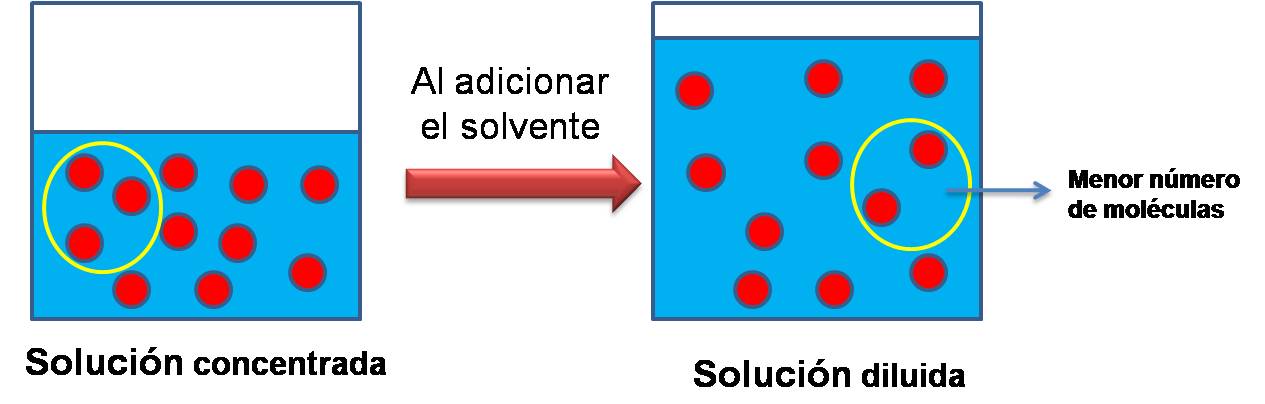
Figura 4. Partículas en una solución. Fuente: @yusvelasquez
Así por ejemplo, si se desea preparar 1 litro de solución de acido nítrico HNO3 a una concentración de 0.1 mol/L partiendo de una solución concentrada de HNO3 1.0 mol/L, es necesario medir 100ml de la solución concentrada para su preparación empleando el agua como solvente. Entre más solvente se adiciona a una solución, mas diluida será pero el número de moles de soluto no se ve alterado.
Aplicación de la técnica de dilución
A nivel de laboratorio, para llevar a cabo la dilución se emplea una pipeta para transferir el volumen apropiado de la solución madre a un matraz aforado, que está calibrado y que contiene un volumen específico. Posteriormente, se adiciona suficiente cantidad de solvente para llevarlo a su valor final.
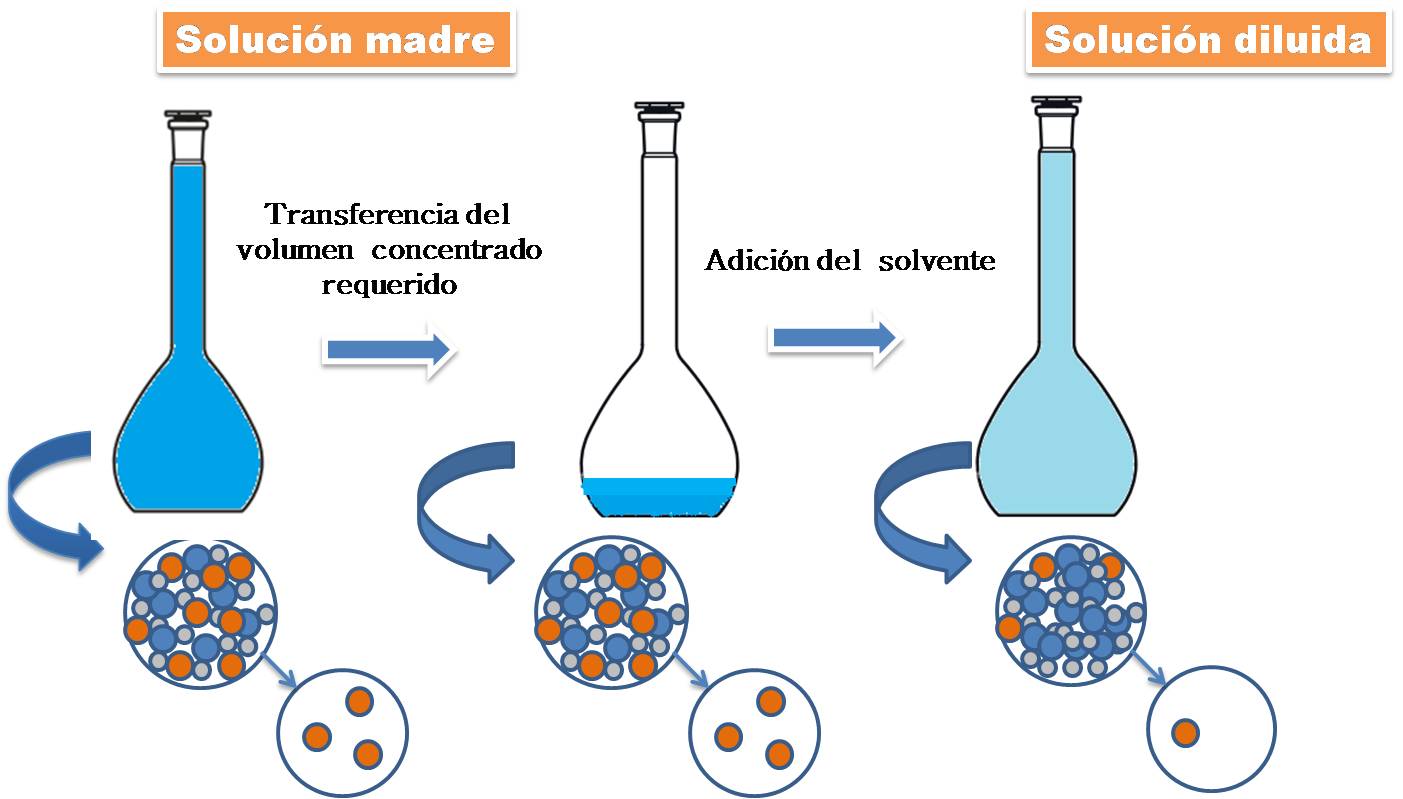
Figura 5. Técnica de dilución. Fuente: @yusvelasquez
Cálculos para determinar el volumen requerido de la solución madre para preparar una solución diluida a una determinada concentración
El procedimiento a seguir consiste en los siguientes pasos siempre que se desee preparar una solución diluida:
Paso 1: Calcular la cantidad de soluto que se debe tomar de la solución madre para transferirlo al matraz aforado
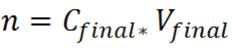
Paso 2: Calcular el volumen de la solución madre que contiene esa cantidad de soluto
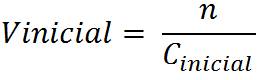
Debido a que la cantidad de soluto, n es la misma en ambos casos se puede expresar de la siguiente manera
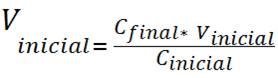
Reordenando queda la siguiente ecuación
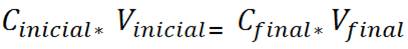
Ejemplo típico
Preparación de una solución ácida
En el laboratorio son muchos los análisis que se realizan con soluciones básicas y ácidas, por ello al momento de prepararlas se debe tomar la precaución de adicionar una pequeña cantidad de agua al balón aforado antes de adicionar la solución madre y luego continuar diluyendo con más solvente, ya que si se agrega agua directamente sobre el ácido o la base concentrados puede provocar salpicaduras por el calor que se genera.

Figura 6. Preparación de soluciones en el laboratorio. Fuente: @yusvelasquez
Los cálculos anteriores se puede aplicar en la preparación de 250mL de una solución de ácido clorhídrico HCl 1,5*10-3 mol/ L a partir de una solución madre de HCl 0.0380 mol/L.
Paso 1:
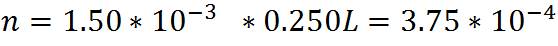
Paso 2:
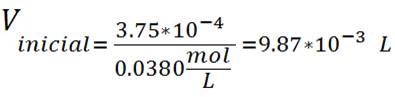
Cabe destacar la importancia del conocimiento del principio de cada proceso para la preparación de soluciones en el laboratorio y la realización de los cálculos necesarios para la obtención de soluciones a determinadas concentraciones, siendo esta una característica clave para llevar a cabo los experimentos y análisis ya que dependiendo de las concentraciones dependerán la confiabilidad de los resultados.
¡Espero la información presentada sea de gran utilidad, hasta una próxima oportunidad!
Referencias
- Harvey, D. (2002). Química analítica moderna. McGraw-Hill.
- Whitten,K. (1985). Químca General). Interamericana
- Atkins, J. (2006). Principios de Química. Panamericana
Hola.
El contenido está didáctico, me recuerda a las clases que compartía una amiga de trabajo.
Saludos.
Hola @eclipsedeluna!
Gracias por tu comentario, la química es muy interesante y siempre esta presente en nuestra vida cotidiana. Saludos!
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.