Curva de valoración. Estudio de caso base débil con ácido fuerte
Hola amigos
La valoración es una técnica muy utilizada en distintas áreas ya que es rápida, precisa y se puede realizar de forma manual o automatizada, lo que permite la determinación cuantitativa de la concentración de distintos analitos como el contenido de sal, acidez, cloruro en los alimentos, la pureza en el ámbito farmacéutico, determinación de ácidos, bases en química o en el análisis de la calidad del agua entre muchos otros y los cambios de una determinada variable se puede estudiar en función al volumen de titulante añadido.
En esta oportunidad se presentan los cálculos que permiten obtener los valores de pH para la construcción de una curva de valoración de una base débil con ácido fuerte. Las curvas de valoración representan el progreso de la valoración, por lo que comprender los distintos casos que se pueden aplicar es fundamental para obtener resultados más precisos y exactos para minimizar los errores.
Fuente: @yusvelasquez
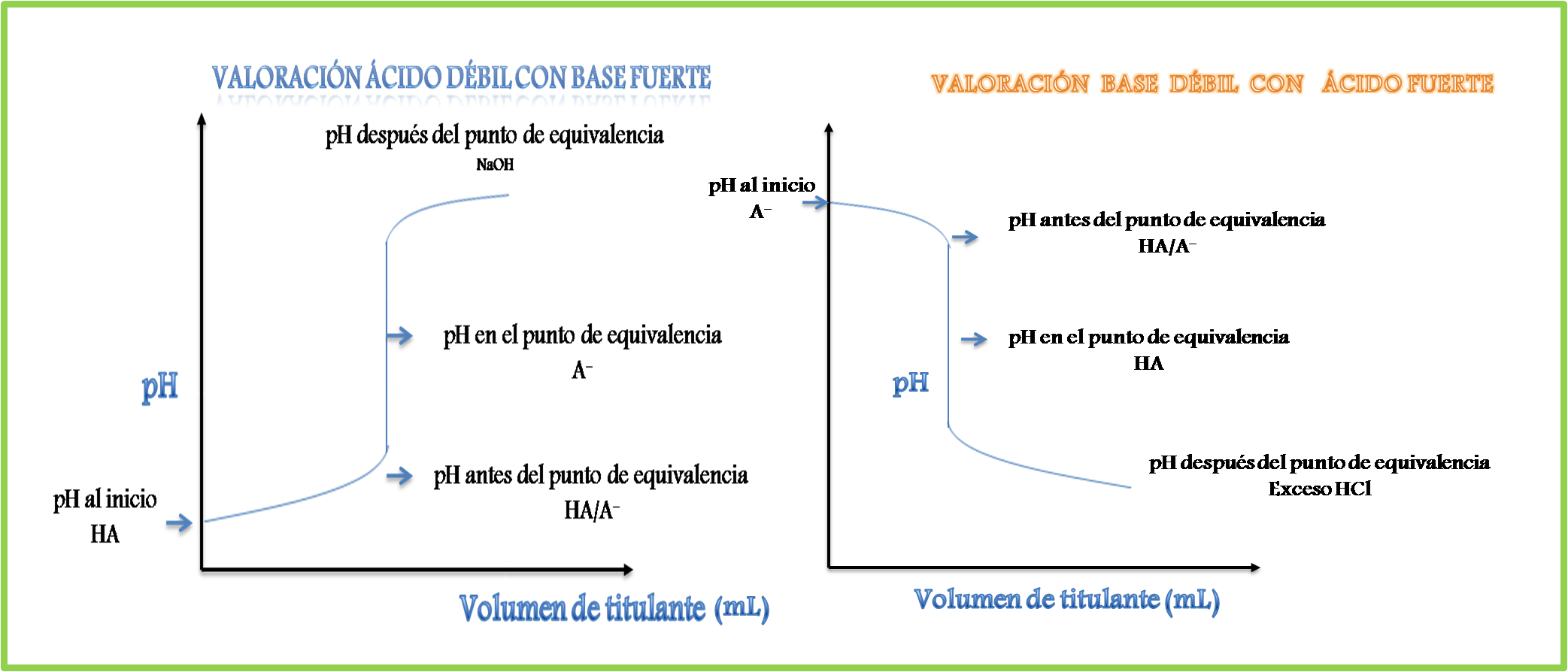
Específicamente se trabajará con la curva de valoración del cianuro de sodio (NaCN) que provee la base CN- con ácido clorhídrico (HCl). Para comprender mejor lo que ocurre a lo largo de la curva de valoración se puede hacer uso de los fundamentos de la curva de valoración de un ácido débil con una base fuerte que fue tratada en un post anterior y cuyas gráficas se pueden representar de la siguiente manera.
Fuente: @yusvelasquez
En la figura se puede observar la similitud que existe entre ambas curvas, ya que se caracterizan por ser sigmoidales y presentar la formación de especies similares, la diferencia se encuentra en el orden en el que se forman, por lo que se pueden emplear los mismos fundamentos.
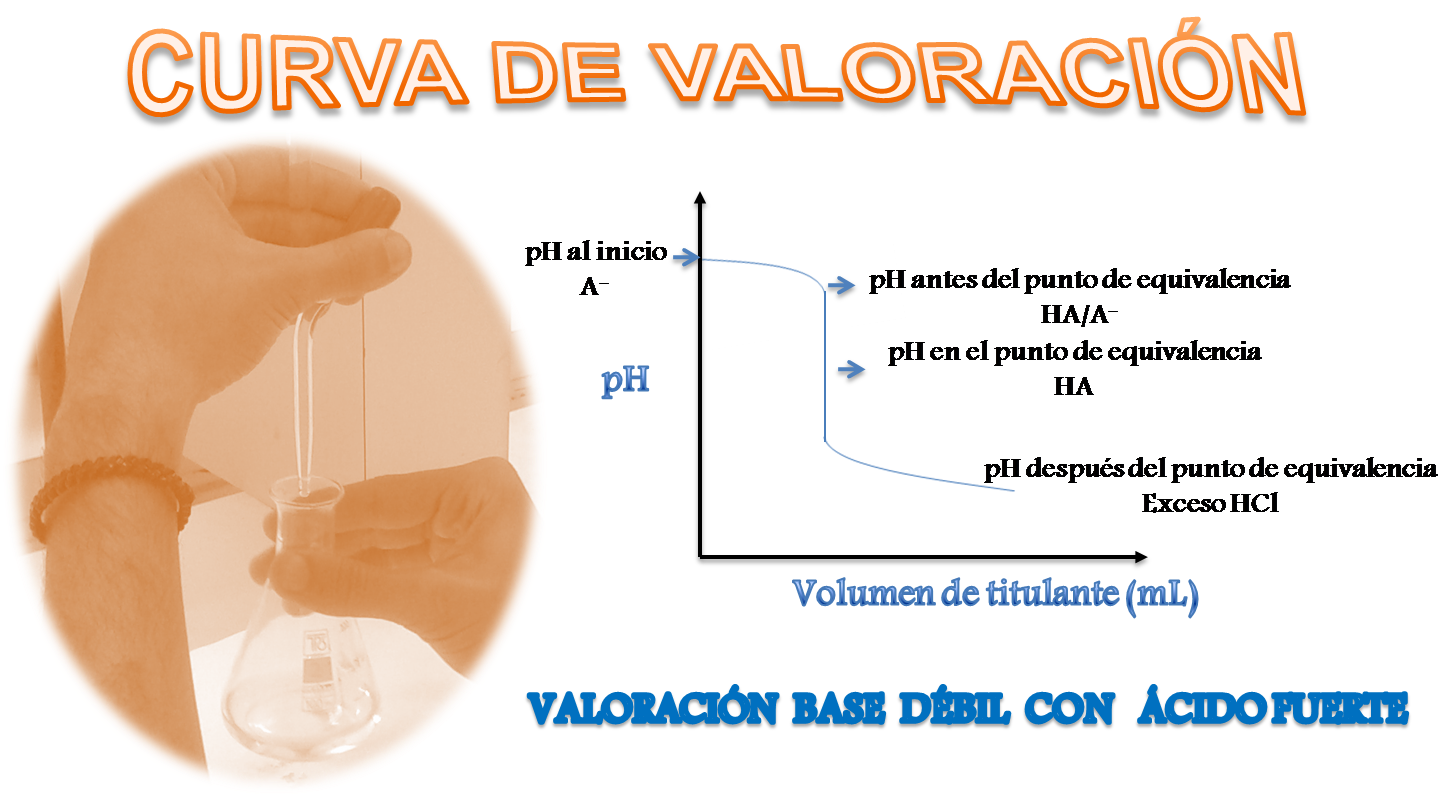
En la curva de valoración que se desarrollará, se observará que al comienzo de la valoración, se parte de un pH alto ya que depende únicamente de la base A-. Antes del llegar al punto de equivalencia se forma una solución reguladora o buffer (HA/A-), se produce un cambio de pH cercano al punto de equivalencia sin embargo no es tan brusco. Al llegar al punto de equivalencia, donde la reacción entre el analito y la solución patrón se completa, el pH depende del ácido débil formado y es distinto a 7. Después del punto de equivalencia el pH depende de la concentración en exceso del ácido añadido.
El pH será calculado en cuatro zonas, ellas corresponden al inicio de la titulación, antes del punto de equivalencia, en el punto de equivalencia y después del punto de equivalencia. Antes y después del punto de equivalencia se pueden calcular otros valores de pH tomando en cuenta que mientras más valores de pH se calculen más definida será la curva, sin embargo aquí solo se presentará un solo cálculo ya que para otros volúmenes seleccionados se puede seguir el mismo procedimiento.
Veamos ahora los cálculos involucrados para la obtención de los valores de pH en cada zona de la curva.
Se tomará como ejemplo, la valoración de 25mL de NaCN 0.025M con HCl 0.05M.
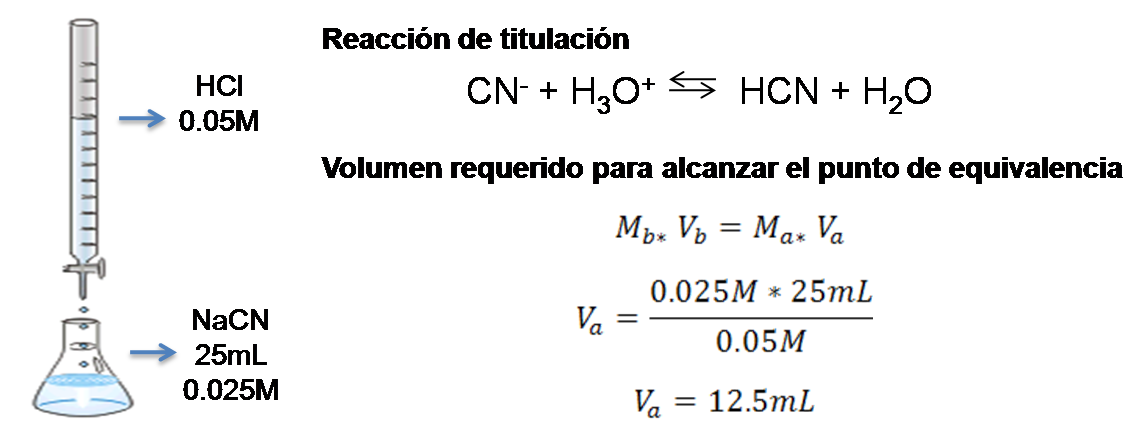
Valoración de NaCN con HCl. Cálculos en el punto de equivalencia. Fuente: @yusvelasquez, contiene imagen de dominio público.
El resultado muestra que para alcanzar el punto de equivalencia se deben adicionar 12.5 mL de HCl. Por lo que los cálculos se realizarán al adicionar 0ml, 8mL, 12.5mL y 13mL de titulante que representarán las distintas zonas de la curva.
Cálculos de pH
- pH al inicio de la titulación: en este punto el volumen de titulante añadido es 0 mL, por lo que el pH depende únicamente de la base (CN-). La reacción de hidrólisis es :
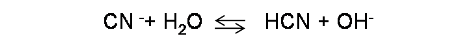
En este caso se debe calcular la constante Kb correspondiente al CN- por medio de la relación Ka y Kb , tomando como referencia el valor de Ka del HCN de la siguiente forma
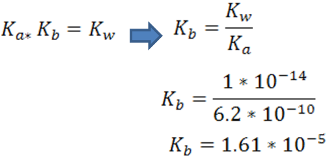
Se procede a completar el cuadro de equilibrio de la base débil
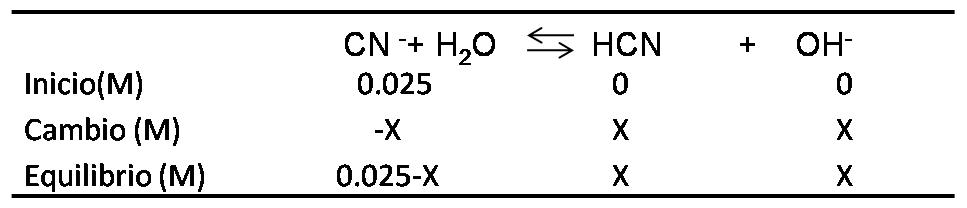
A partir de la expresión de Kb se obtiene el valor de X que corresponde a la concentración de OH-
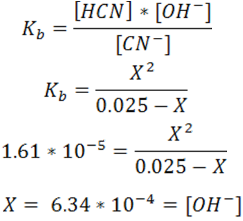
Por tanto el pH es
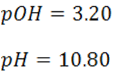
- pH antes del punto de equivalencia: en esta zona el cálculo se realizará al añadir 8 mL de HCl tomando en cuenta que la especie predominante es esta zona es el buffer que se forma.
En primer lugar, se calculan los moles iniciales
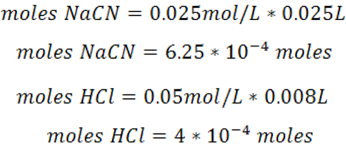
Con esta información se completa el cuadro de equilibrio
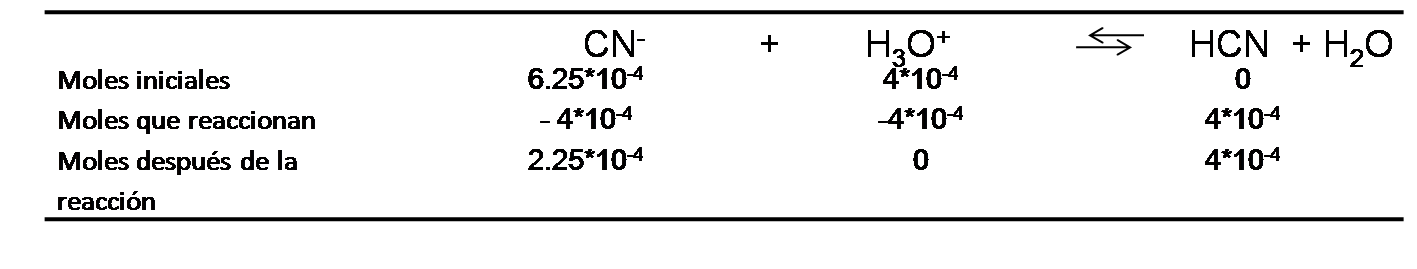
Se calculan las concentraciones en el equilibrio
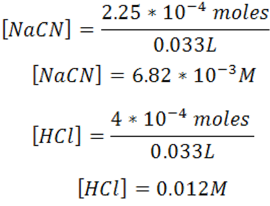
Se calcula el pH de la solución amortiguadora empleando la ecuación de Henderson-Hasselbalch
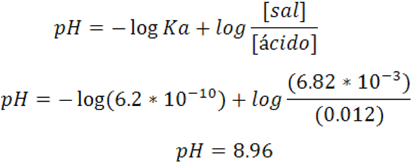
- En el punto de equivalencia se debe añadir un volumen de 12.5mL de HCl. En este punto la especie predominante es el ácido débil formado HCN.
Se calculan los moles de producto empleando el cuadro de equilibrio
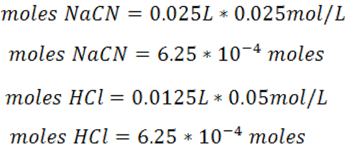
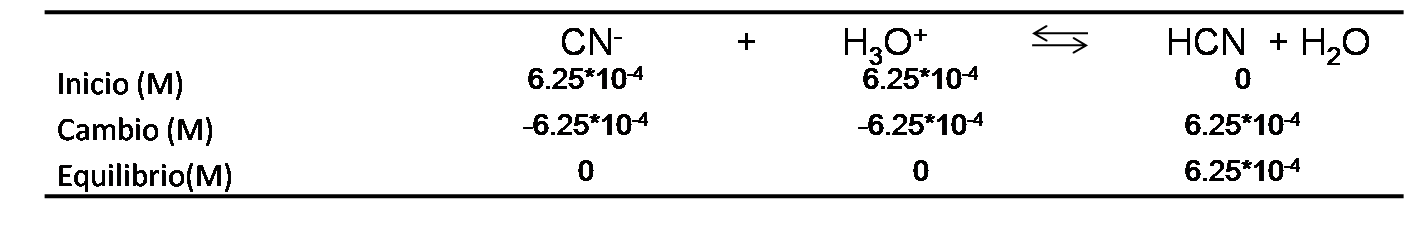
Se calcula la concentración del ácido
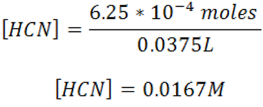
La disociación del ácido viene dada por
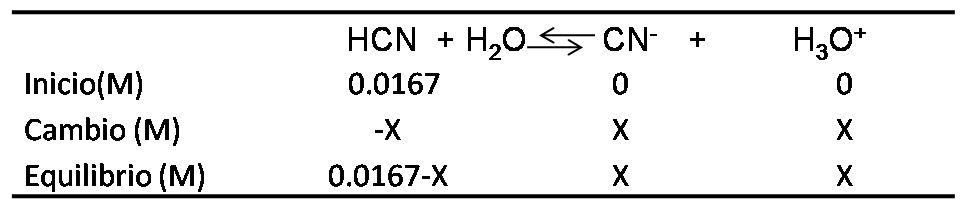
El pH se obtiene a partir de la expresión de Ka
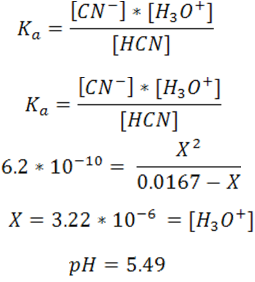
- El pH después del punto de equivalencia depende del exceso de ácido añadido, en este caso se trabajará con 13mL de HCl.
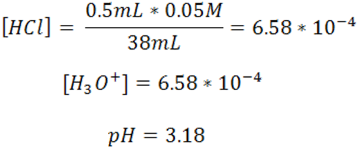
Curva de valoración
En este caso la curva resultante es la que se muestra en la siguiente figura
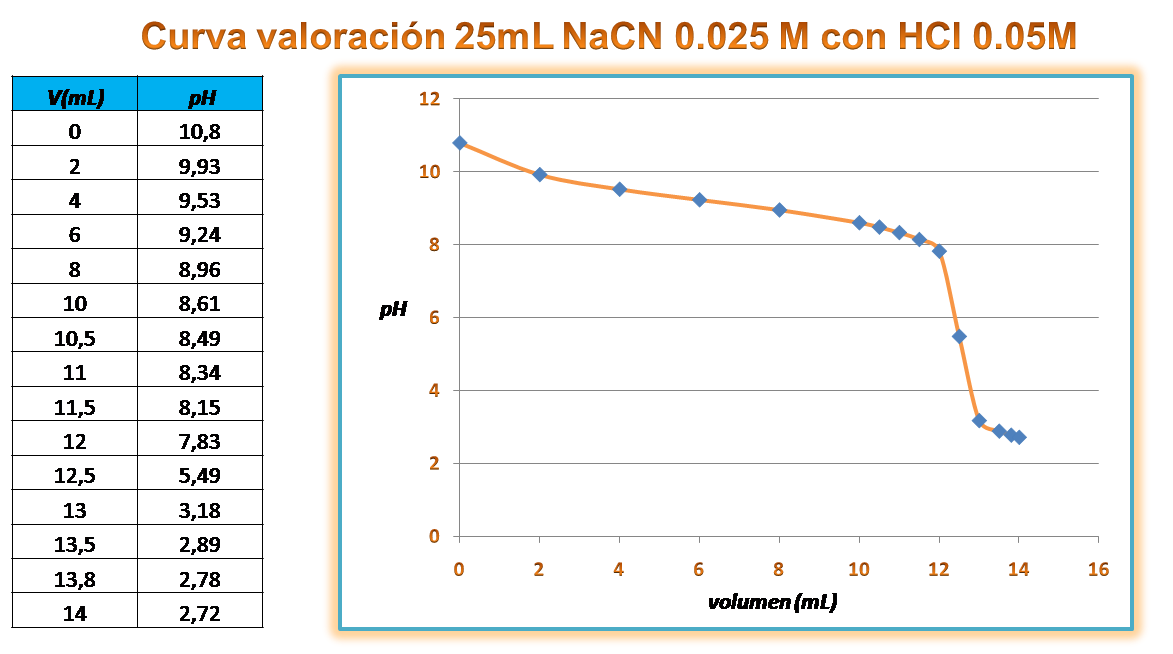
Fuente:@yusvelasquez
La curva se realizó en excel complementando la gráfica con otros cálculos de pH en la zona antes y después del punto de equivalencia para una mayor precisión siguiendo los pasos mostrados. Hay que destacar que cuando se titula una base débil el indicador se selecciona con un rango de cambio de color ácido.
Conclusión
En toda valoración es importante conocer la reacción química que se lleva a cabo y de esta manera determinar la especie predominante en cada zona, ya que de ello dependerá el pH. Las gráficas muestran la variación de pH al adicionar el titulante, permiten seleccionar el indicador adecuado y comparar los resultados obtenidos en el laboratorio por lo que deben emplearse las ecuaciones adecuadas.
¡Hasta aquí el presente post amigos, espero que la información les sea de mucha utilidad, gracias por leer!
Referencias
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
- Hamilton, S. Cálculos de Química Analítica. Mc Graw Hill. Séptima edición
- Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
- Valoración
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.