Construcción de una curva de valoración de un ácido fuerte con una base fuerte
¡Hola estimados amigos de la comunidad científica de Hive!
En esta oportunidad les presento los cálculos necesarios para la construcción de una curva teórica de una valoración ácido/base. Entre los tipos de curvas de valoración de ácidos y bases monopróticos más comunes se encuentran la valoración de un ácido fuerte con una base fuerte, valoración de una base fuerte con ácido fuerte, valoración de un ácido débil con una base fuerte y valoración de una base débil con un ácido fuerte. En este post les estaré mostrando específicamente el caso de una valoración de un ácido fuerte como lo es el ácido clorhídrico HCl con una base fuerte, hidróxido de sodio NaOH.

Valoración de un ácido fuerte con base fuerte
En estas curvas hay que considerar los cambios de pH que se dan a través de ella. Al comienzo de la valoración, partimos de un pH bajo y que se puede calcular por medio de la concentración del ácido fuerte. Antes del punto de equivalencia, tendremos un exceso de HCl que aún no ha reaccionado, por lo que el pH depende en esta zona de la concentración de dicho exceso. En el punto de equivalencia, la reacción se completa y los moles del ácido son iguales a los moles de la base. Como no hay exceso ni del ácido ni de la base el pH está determinado por la disociación del agua. Más allá de este punto, el pH dependerá de la concentración en exceso de la base añadida.
Zonas de la curva
Para la construcción de una curva de valoración teórica vamos a calcular el pH en cuatro zonas, ellas corresponden a:
- pH al iniciar la titulación
- pH al adicionar un determinado volumen de titulante
- pH en el punto de equivalencia
- pH después del punto de equivalencia
Ejemplo típico. Construcción de una curva de valoración de 50mL de HCl 0.01mol/L con NaOH 0.02 mol/L
Primer paso: Calcular el pH al inicio de la titulación, es decir cuando el volumen de titulante añadido es 0mL. Antes de adicionar la base, la solución tiene una [H3O+]= 0.01 mol/L y el pH se puede calcular de la siguiente manera:
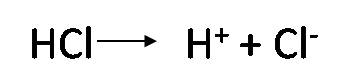
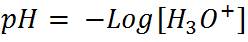
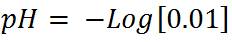
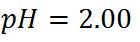
Segundo paso: Calcular el pH antes del punto de equivalencia. Para ello podemos comenzar adicionando un volumen de base igual a 5 mL. Escribimos la reacción implicada en la valoración, en este caso la reacción de neutralización.
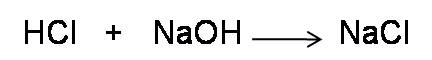
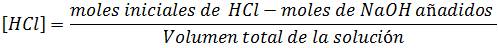
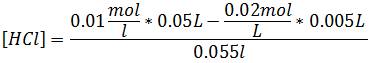
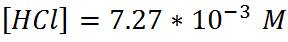
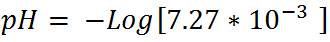
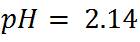
Cabe destacar que todos los puntos que se tomen en esta región previa al punto de equivalencia se pueden calcular de la misma manera.
Tercer paso: Calcular el pH en el punto de equivalencia. En este punto, el pH se calcula en función al producto iónico del agua.
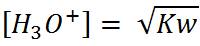
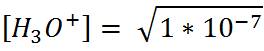
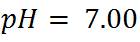
Cuarto paso: Calcular el pH después del punto de equivalencia. Este cálculo se puede realizar adicionando cualquier volumen después de 25mL.
Trabajaremos con 26mL de titulante. En esta zona se calcula el exceso de base de la siguiente manera:
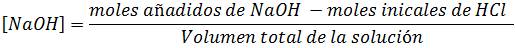
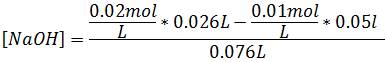
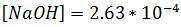
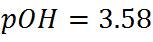
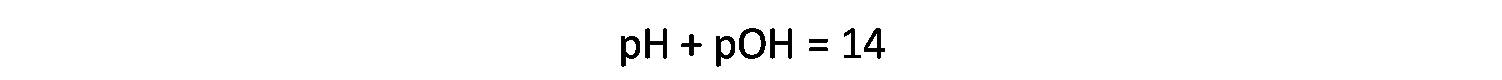
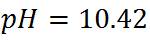
Para obtener los datos en esta región empleando otros volúmenes de titulante se pueden aplicar las mismas ecuaciones.
Como sabemos, para la obtención de una curva más definida es necesario el cálculo de pH empleando más volumen de titulante, por lo que una manera más sencilla y rápida de obtenerla es mediante el uso de herramientas adecuadas como por ejemplo una de cálculo elaborada en Excel. Para el ejemplo mostrado se diseñó la siguiente hoja de cálculo, que tiene la ventaja de que se puede emplear con distintas especies y concentraciones.
En su elaboración sólo se deben ingresar los datos de las especies involucradas, en este caso las concentraciones y los volúmenes del ácido y de la base.
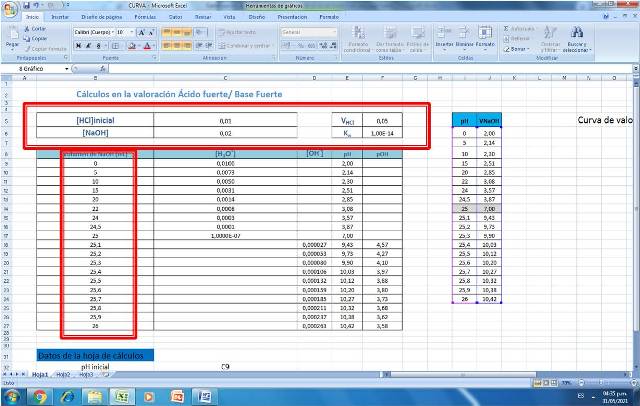
Figura 2.Datos para la construcción de una curva de valoración de un ácido fuerte con base fuerte. Fuente: @yusvelasquez
Ingresar la ecuación correspondiente para el cálculo del pH en cada zona
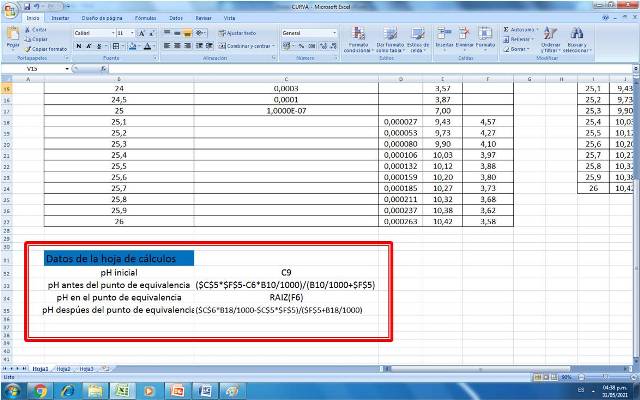
Figura 3. Ecuaciones empleadas para la construcción de una curva de valoración de un ácido fuerte con base fuerte. Fuente: @yusvelasquez
Finalmente elaborar el gráfico con los datos de pH volumen de titulante.
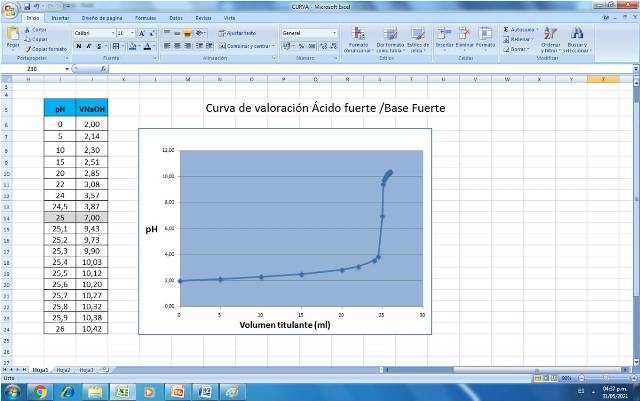
Figura 4. Curva de valoración de un ácido fuerte con base fuerte. Fuente: @yusvelasquez
Cabe destacar que la curva de valoración de una base fuerte con ácido fuerte se puede obtener de manera semejante a la presentada. Con la diferencia de que partimos de un pH alto. Al inicio de la titulación la solución es básica, en el punto de equivalencia la solución es neutra y al sobrepasar este punto se vuelve ácida.
Selección de indicador
La elección del indicador, con el cual podemos observar el punto final de la titulación se hace en función al pH que se tenga en el punto de equivalencia, en este caso el pH es neutro igual a 7.00. Estas sustancias por lo general son ácidos o bases débiles que cambian de color dependiendo del pH del medio donde se encuentran y su variación de color se debe al arreglo de átomos cuando se disocian. En esta valoración se puede emplear el azul de bromotimol y la fenolftaleína. El azul de bromotimol tiene un viraje entre 6.2-7.6 y la fenolftaleína entre 8.3-10.0. En laboratorio generalmente se emplea fenolftaleína y su cambio de color es de incoloro a rosa.

Figura 5. Valoración de un ácido fuerte con una base fuerte a nivel de laboratorio. Fuente: @yusvelasquez
Aplicación
Las titulaciones de neutralización son ampliamente utilizadas para determinar las concentraciones de muchas especies orgánicas, inorgánicas que tengan propiedades ácido-base. Es importante conocer cómo construir teóricamente una curva de valoración para así determinar el pH, en especial en el punto de equivalencia, y seleccionar el indicador adecuado para la valoración, así como también analizar las distintas especies que se forman a lo largo de la reacción. De esta manera podremos realizar una comparación con la curva que se realice en el laboratorio y calcular el margen de error.
¡Hasta aquí el presente post amigos, espero que la información les sea de mucha utilidad!
Referencias
Skoog, W.(2000) Química Analítica. Mc Graw Hill
Hamilto, S. Cálculos de Química Analítica. Mc Graw Hill. Séptima edición
Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.