Caracteristicas de los óxidos
Hola amigos
Por ejemplo, como se sabe la principal función del aparato respiratorio es la de inhalar O2 y expulsar CO2, éste ultimo compuesto se conoce como dióxido de carbono o anhídrido carbónico, y corresponde a uno de los óxidos que puede formar el carbono.
Este compuesto existe como un gas incoloro en condiciones estándar de temperatura y presión e inodoro en bajas concentraciones. Adicionalmente existen otros óxidos gaseosos como el SO2, SO3, NO, NO2 que se pueden producir en forma natural en la combustión de bosques.
Es también conocido que cuando estos óxidos gaseosos están en el ambiente y entran en contacto con la lluvia se transforman en ácidos como H2SO3, H2SO4, HNO3 formando lo que se conoce como lluvia ácida afectando el ambiente.
Por otra parte, es posible observar desde hace mucho tiempo el uso del CaO, óxido de calcio o comúnmente llamado cal, un compuesto de color blanco o blanco grisáceo en trabajos de construcción, pintura de muros o fachadas.
Las cenizas vegetales por ejemplo, están constituidas por óxido de potasio K2O y óxido sodio Na2O que al disolverse en agua forman álcalis.
Ahora bien, ¿qué tienen en común los compuestos antes mencionado?
Como vemos, son compuestos que resultan cuando se combinan con oxígeno, y son llamados Óxidos y estos pueden ser gaseosos, sólidos y con menos frecuencia líquidos, adicionalmente destaca también su comportamiento frente al agua.
A continuación nos enfocaremos en presentar información relacionada específicamente con los óxidos.

Los óxidos pueden ser básicos o ácidos.
- Un óxido básico, se forma de la unión de un elemento metal con el oxígeno. Por ejemplo la reacción entre el sodio y el oxígeno.
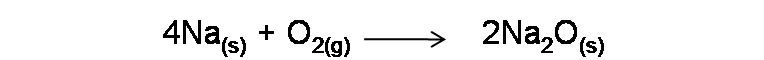
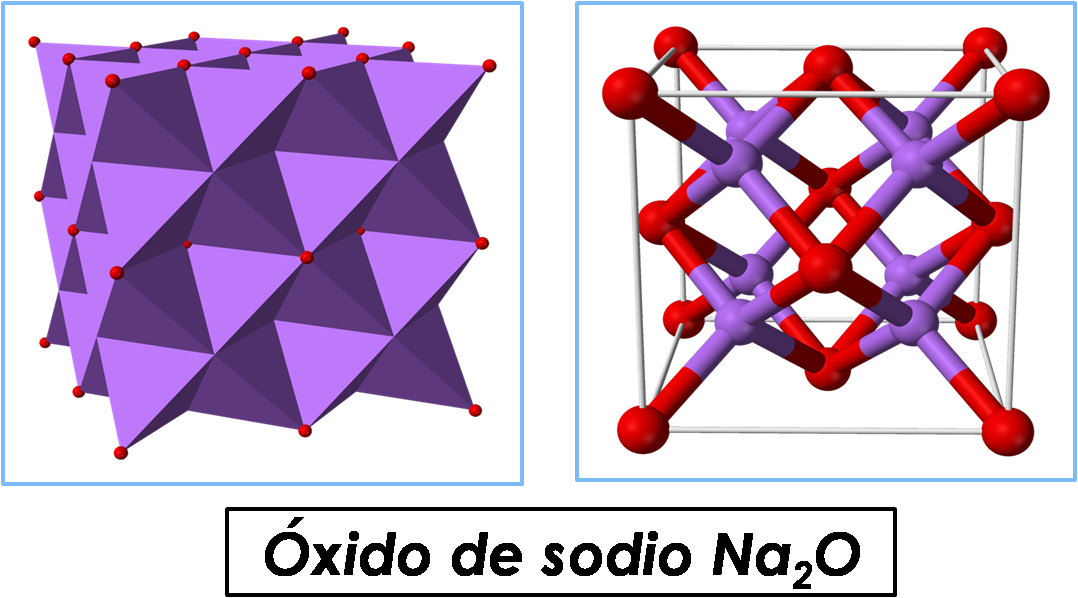
Imagen realizada en power point con imágenes de dominio público:1;2_
En general, estos compuestos se caracterizan por ser buenos conductores de la electricidad y el calor.
Los metales poseen baja energía de ionización por lo que generalmente se combinan con el oxígeno formando sólidos iónicos en los que el oxígeno está presente como ion óxido (O-2). Esto ocasiona que los metales posean una alta energía de enlace y por ende los puntos de fusión y ebullición de estos óxidos son generalmente altos y la mayoría son insolubles en agua.
Cabe destacar que la solubilidad de estos óxidos en el agua depende en gran medida del tamaño y la carga asociada al catión y es más grande en los cationes grandes que tienen una carga baja.
Por ejemplo, los óxidos de los metales alcalinos como el Na2O son solubles, así como también los óxidos de los metales alcalinotérreos como el Bario y tienen la propiedad de reaccionar con el agua para formar hidróxidos o bases, de allí que se conocen también como óxidos básicos.

Por otra parte, algunos óxidos que no se disuelven en agua, se disuelven en soluciones ácidas esto debido a la reacción entre el H+ y el O-2 para formar agua. Por ejemplo el Fe2O3
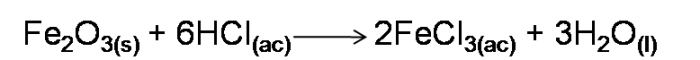
En esta clasificación se puede incluir el óxido de magnesio MgO, el óxido de Zinc ZnO, óxido de aluminio Al2O3 entre otros.
- Un óxido ácido, se forma de la unión de un elemento no metal con el oxígeno. Por ejemplo la reacción entre el azufre y el oxígeno.
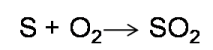
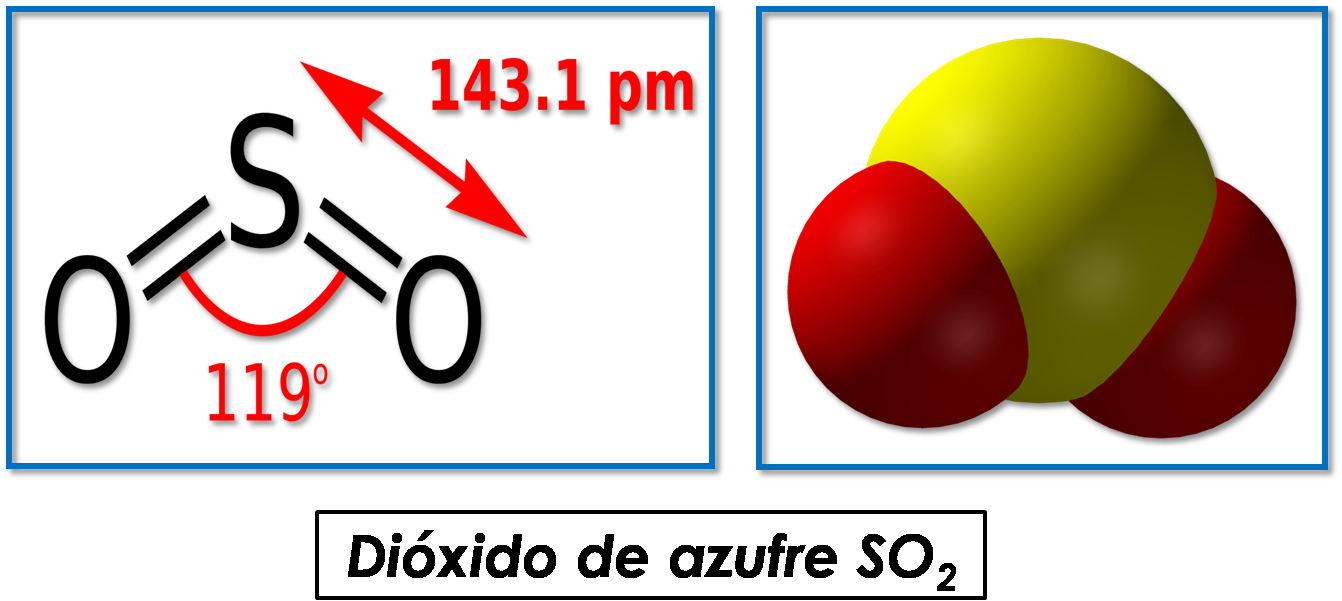
Imagen realizada en power point con imágenes de dominio publico:1;2
Estos compuestos a diferencia de los óxidos básicos no son buenos conductores de la electricidad y el calor.
Debido a que los no metales tienen una alta electronegatividad, esto evita que el oxígeno forme ion óxido, por lo que en las combinaciones forman moléculas unidas por enlaces polares covalentes. En su mayoría son gases, líquidos o sólidos con bajos puntos de fusión.
Estos compuestos, se disuelven en agua para formar disoluciones ácidas, o disolverse en disoluciones básicas como ele NaOH. Por ejemplo el Cl2O7 se disuelve en agua formando el ácido perclórico.
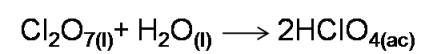
Aplicaciones de los óxidos
Son muchas las aplicaciones de estos compuestos, entre ellos podemos mencionar el óxido de zinc como óxido básico y el anhídrido silícico como óxido ácido.
El oxido de zinc (ZnO) es un compuesto caracterizado por ser un polvo blanco, insoluble en agua y se emplea generalmente como aditivo en diversos materiales como cauchos, cerámicas, plásticos, cemento entre otros.
En el área de la medicina se usa para el tratamiento de diversas condiciones en la piel, en productos como polvo para bebés, cremas protectoras para rozaduras, champús anti caspa, y ungüentos antisépticos. Puede ser usado en ungüentos, cremas, y lociones para proteger contra quemaduras por el sol y otros daños a la piel causados por la luz ultravioleta.

Imagen realizada en power point con imagen de dominio publico 1y propia
El anhídrido silícico (SO2) u óxido de silicio (IV) es conocido comúnmente como sílice. En su estructura está ordenado espacialmente en una red tridimensional y forma el cuarzo y todas sus variedades, también se puede encontrar en estado gaseoso, siendo un gas incoloro, de olor ligeramente irritante. Es uno de los componentes de la arena, se emplea para fabricar cemento, cerámicas, sirve como desecante entre otros. Es uno de los componentes mas abundante en la corteza terrestre.

Imagen realizada en power point con imagen de dominio publico 1,2
Como vemos el estudio de los compuestos inorgánicos resulta muy interesante e importante, ya que tienen múltiples aplicaciones en diferentes áreas como en la producción de materiales, productos farmacéuticos, en la industria alimentaria, en el área ambiental entre otros, por lo que conocer sus características y propiedades permiten entender también muchos procesos que ocurren en la vida diaria.
¡Gracias por leer!
Referencias
- Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México.
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editorial Interamericana.
- óxido de zinc. wikipedia.org
- óxido de silicio (Iv)wikipedia.org
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.