Cálculos volumétricos asociados a una reacción redox
Hola estimados amigos


Fuente: imagen de dominio público editada en power point wikipedia.org
En este tipo de cálculos es importante destacar que la estequiometría de la reacción redox viene dada por la conservación de los electrones entre el agente oxidante y el agente reductor.
Veamos algunos ejemplos

Este ejemplo se puede resolver de la siguiente forma:
Paso 1: Planteamiento
Partiendo de la reacción en el punto de equivalencia se pueden determinar en primer lugar los moles de Fe+2 y estableciendo la relación con el Fe2O3 se calculan los moles de Fe2O3 y posteriormente se transforman en gramos del compuesto empleando la masa molar.
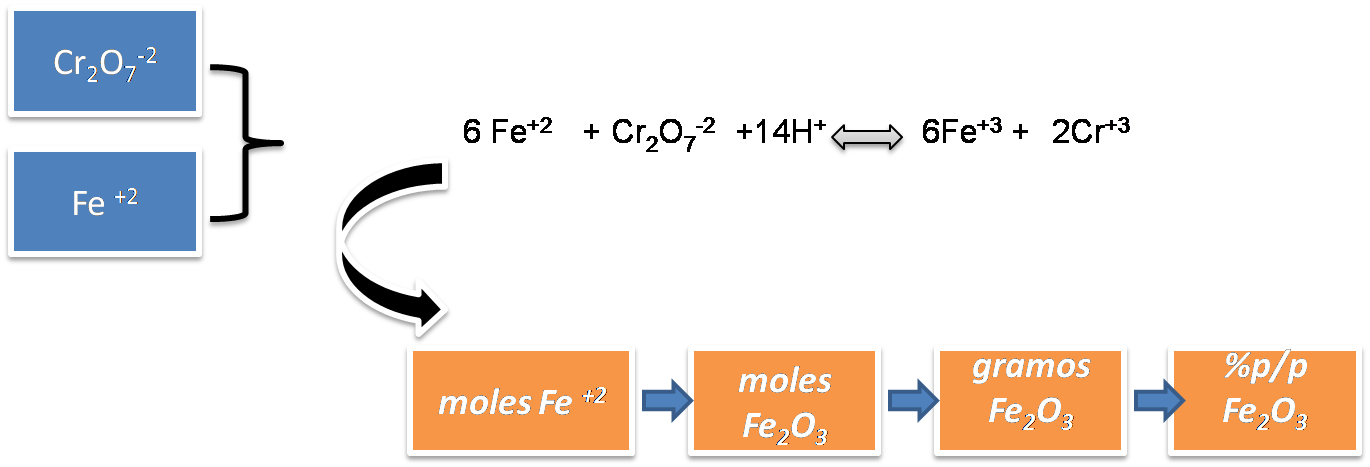 Fuente: @yusvelasquez
Fuente: @yusvelasquezPaso 2: Definición de la incógnita
La concentración se puede determinar por la siguiente ecuación:

Paso 3: Cálculo de los moles de Fe+2 y moles Fe2O3
En este punto se deben tomar en cuenta las semireacciones de las especies involucradas tomadas de la bibliografía [1].
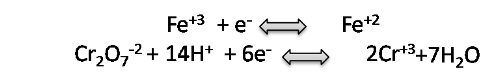
Se realiza el ajuste y balance correspondiente y al sumar ambas semireacciones obtendremos la reacción de titulación:
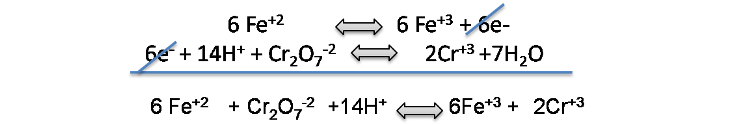
De esta reacción se puede establecer la relación entre el analito y el titulante.
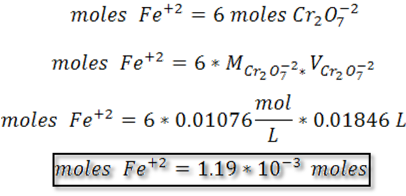
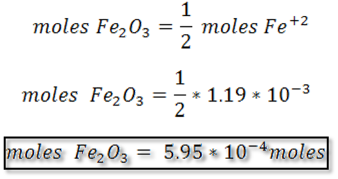
Paso 4: Cálculo gramos de Fe2O3
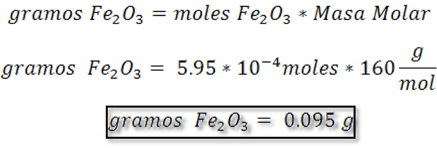
Paso 5: Calculo del %p/p Fe2O3
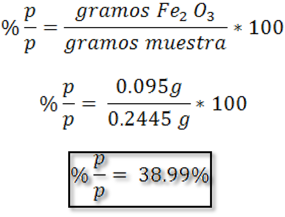
Como se observa la muestra contiene 38.99% de Fe2O3

Las reacciones involucradas son:
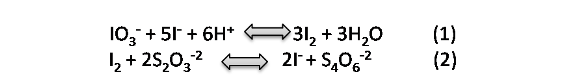
Este ejemplo se puede resolver de la siguiente forma:
Paso 1: Planteamiento
En primer lugar se deben calcular los moles de I2 producidos en la primera reacción a partir de la relación con el KIO3, y luego se calculan los moles de tiosulfato partiendo de la segunda reacción y estableciendo la relación en el punto de equivalencia con el I2 y así calcular su molaridad.
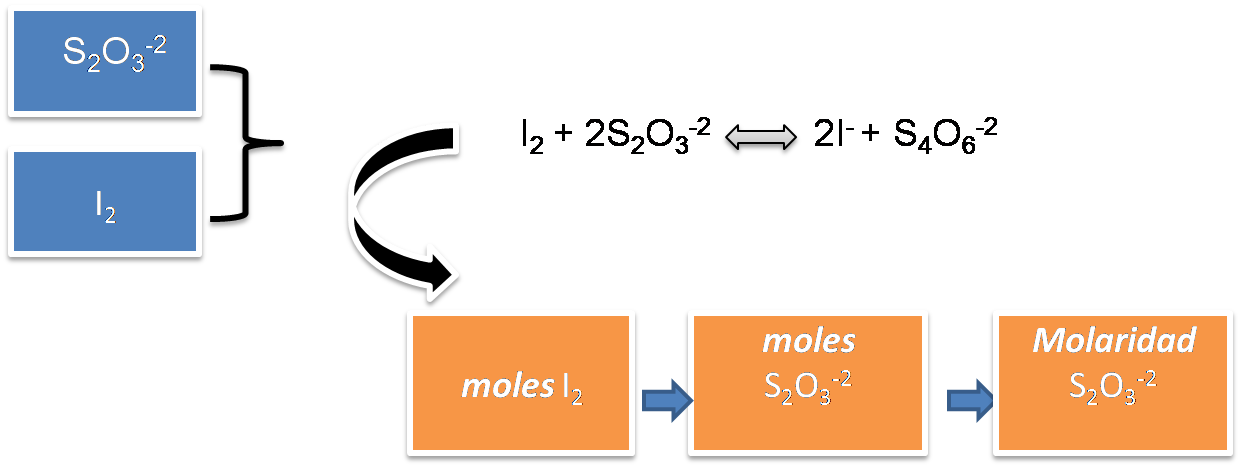 Fuente: @yusvelasquez
Fuente: @yusvelasquezPaso 2: Definición de la incógnita
En este caso la concentración del Na2S2O3 se puede obtener por la siguiente ecuación:
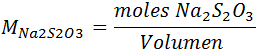
Paso 3: Cálculo de los moles de I2
En este caso se trabajará con la primera reacción y la relación entre el KIO3 y el I2 en el punto de equivalencia que viene dada por:
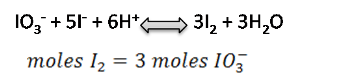
Los moles de IO3- se calculan a partir de los gramos de KIO3 y su masa molar
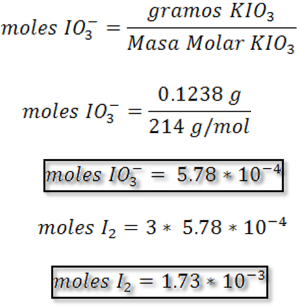
Paso 4: Cálculo moles Na2S2O3
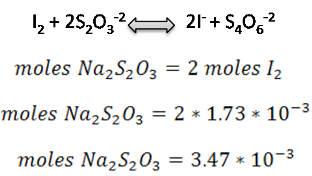
Paso 5: Cálculo molaridad Na2S2O3
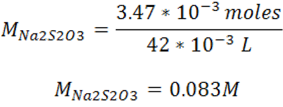
En este caso la molaridad del agente reductor es de 0.083M
Como vemos en las reacciones redox es muy importante tomar en cuenta la estequiometría de la reacción para la realización de los cálculos y dependen de los electrones que se transfieren, así como también es posible que el analito sea tratado previamente hasta un estado donde es posible realizar la titulación.
En ocasiones pude pensarse que este tipo de cálculos son complicados, sin embargo, es posible resolverlos dominando los conceptos básicos de la electroquímica así como también los métodos de balanceo de las reacciones redox y las sustancias que se emplean en las diferentes determinaciones.
Hasta aquí la información. Espero les sea útil, gracias por leer
Referencias
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
- Harvey D., (2000) Química analítica moderna. Mc Graw Hill
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.