Estados de Agregación de la materia… Cambios de Fases.
¡Excelente comienzo de semana tengan todos los usuarios de la plataforma Hive! Estamos nuevamente por acá el día de hoy con un nuevo tema y cerrando la serie que comencé sobre calor y temperatura, en esta ocasión conoceremos sobre los estados de agregación de la materia.
 Imagen realizada con la página web de diseño gráfico y composición de imágenes Canva.
Imagen realizada con la página web de diseño gráfico y composición de imágenes Canva.La materia comúnmente, se encuentra en tres estados o fases: fase sólida, fase liquida y fase gaseosa. Estos estados de las sustancias dependen de su energía interna.
En la fase sólida, los cuerpos tienen forma y volumen definidos por el arreglo interno de su estructura molecular. A temperatura ambiente, la mayoría de los metales son sólidos con estructuras cristalinas bien organizadas. Otros sólidos, como el vidrio, presentan estructuras amorfas, no cristalinas. En ambos casos, las moléculas del sólido se encuentran fuertemente atadas a la estructura interna y no hay desplazamiento significante de las mismas.
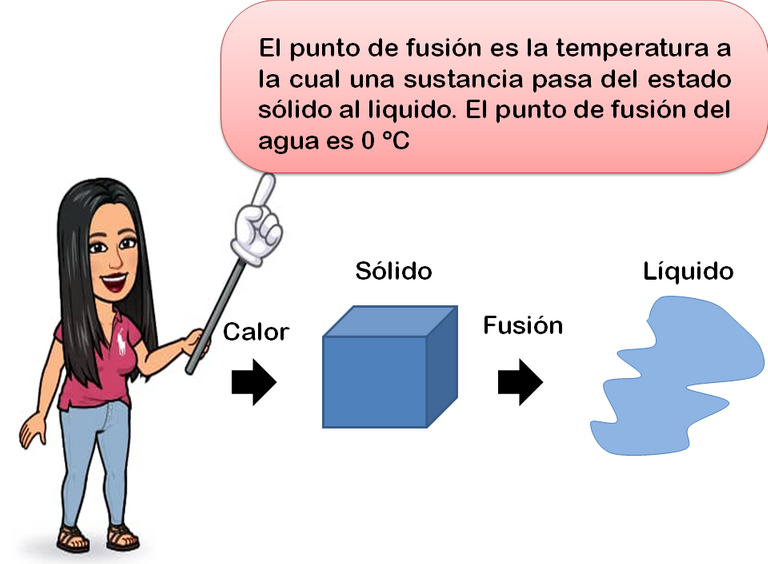
Al suministrar calor a un sólido, se puede llegar a romper los enlaces intermoleculares, originando la conversión de la fase solida a la liquida. La temperatura a la cual se produce este cambio de fase se denomina punto de fusión. Igualmente, un líquido puede pasar al estado sólido. La temperatura a la cual esto tiene lugar se llama punto de solidificación o punto de congelación. En este último caso, se extrae calor del líquido, se reduce el movimiento molecular y, por tanto, aumenta la fuerza de atracción entre moléculas.
La solidificación del agua (su conversión a hielo) se produce cuando se extrae energía de la misma. Cuando se alcanza una temperatura 0 ºC, a presión atmosférica, se produce el cambio del estado líquido al sólido. Si se añade sal al agua, se produce un descenso en la temperatura de solidificación, debido a la presencia de moléculas extrañas en la estructura molecular normal del agua. Esto tiene aplicación en el uso de anticongelantes.
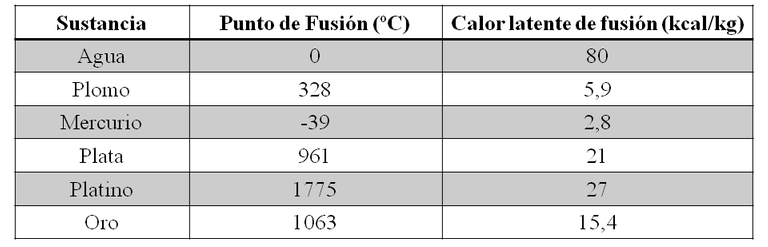
Durante la fusión, la temperatura del sólido permanece constante y es necesario suministrarle calor para que se produzca el cambio de fase. A la cantidad de calor que debe suministrársele por unidad de masa se le conoce como calor latente de fusión y es un valor característico para cada sustancia. El calor latente de fusión se le conoce por la letra L. En la imagen gràfica que se presenta a continuación se indican el punto de fusión en ºC y el calor latente de fusión en Kcal/Kg de algunas sustancias, a la presión de 1 atmosfera.
Aun cuando los sólidos pasan al estado líquido sin antes pasar por el estado gaseoso, algunas sustancias, como la naftalina y el hielo seco, pasan directamente al estado gaseoso en un proceso llamado sublimación.
En los líquidos, la fuerza de cohesión de las moléculas es más débil que en los sólidos. Como consecuencia, hay una mayor movilidad de las moléculas que los conforman, lo que conlleva a tres características:
- Fluyen con notable facilidad.
- Adoptan la forma del recipiente que los contiene.
- No ofrecen gran resistencia a la penetración.
En general, los líquidos no presentan estructuras cristalinas ordenadas. Los llamados cristales líquidos, usados ampliamente en relojes y otros artefactos electrónicos, son una excepción a este comportamiento.
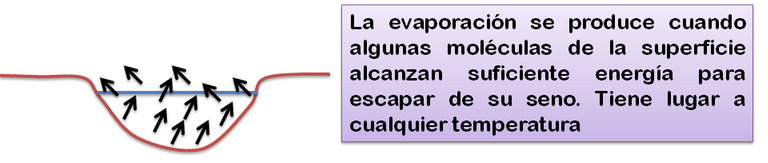
Los líquidos pueden cambiar al estado gaseoso mediante dos mecanismos: evaporación y ebullición. En el caso de la evaporación, el cambio de fase liquida a gaseosa se produce lentamente, a cualquier temperatura. El mecanismo de evaporación es consecuencia del constante estado de agitación de las moléculas. Algunas de ellas alcanzan suficiente energía para escapar del seno del líquido, pasando al estado gaseoso. La evaporación hace disminuir la temperatura del líquido, ya que la energía cinética, ganada por las moléculas que escapan, se manifiesta en un perdida de energía cinética de las moléculas que permanecen en su seno. Como resultado, la energía interna del líquido disminuye y, por tanto, también disminuye su temperatura.
El proceso de evaporación tiene gran importancia en el ecosistema y en la vida sobre nuestro planeta. Cuando el cuerpo humano, por factores externos, se calienta, inmediatamente entran en acción las glándulas sudoríparas y se produce sudor que, al evaporarse por la piel, hace que la temperatura interior disminuya. De esta manera, se conserva la temperatura a un valor normal de 36 ºC. Otras formas de vida apelan a mecanismos distintos para regular su temperatura interior; es el caso de los perros y los cerdos, los cuales no tienen glándulas sudoríparas y controlan su temperatura jadeando permanentemente, en el caso de los perros, y los cerdos toman un refrescante baño en sus charcos.
La evaporación de una sustancia líquida está sujeta a diversos factores, entre los que destacan los siguientes:
La temperatura del líquido: a mayor temperatura hay también un mayor incremento en la energía y, por lo tanto, un incremento en el número de moléculas que pueden escapar del líquido.
La superficie libre del líquido: cuanto más grande es la superficie del líquido expuesta al estado gaseoso (ejemplo el aire), mayor es la cantidad de moléculas que pasan de un estado al otro. Es más fácil, por así decirlo, que una porción de café con leche se enfríe en un plato que en una taza.
Es importante destacar que, la evaporación juega un papel primordial en el ciclo del agua que se da en nuestro planeta. La gran cantidad de agua que se evapora en las superficies de los lagos y mares, y posterior ascensión hacia las capas altas de la atmosfera, produce las lluvias, que son esenciales en el mantenimiento de la vida.
El otro proceso, mediante el cual un líquido puede pasar al estado gaseoso, es por ebullición. En el proceso de evaporación, el cambio de estado líquido a gas tiene lugar en la superficie. Es decir que, bajo condiciones apropiadas, este mismo cambio puede darse debajo de la superficie del líquido; cuando se aumenta considerablemente la temperatura, se forman burbujas en el seno del líquido, haciéndole cambiar al estado gaseoso. Esto se conoce como ebullición; la temperatura a la cual esto sucede se le conoce como punto de ebullición. Un ejemplo de ello, es el punto de ebullición del agua a presión atmosférica es de 100 ºC; es importante acotar que durante el cambio de fase de liquido a gas por ebullición, la temperatura permanece constante, aun cuando haya que suministrar calor para mantener el proceso. A la cantidad de calor unidad de masa, que debe proporcionarse para que se produzca el cambio de fase, se le llama calor latente de vaporización.
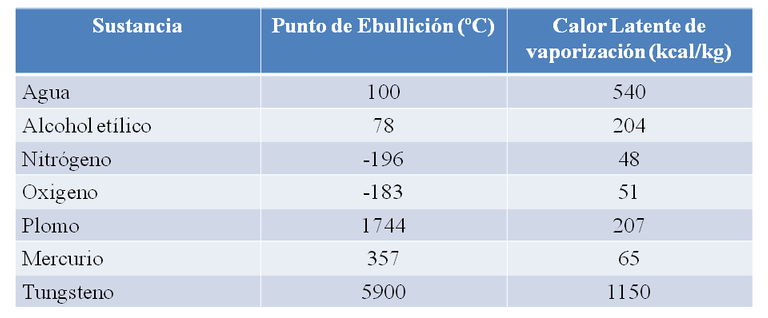
En la tabla que presento a continuación podemos ver el punto de ebullición y el calor latente de vaporización de algunas sustancias a 1 atmosfera de presión. Observemos que en algunas sustancias como el Nitrógeno y el Oxigeno hierven a temperaturas muy por debajo de 0 ºC y que otros, como el Tungsteno, tienen puntos de ebullición muy altos.
En esta fase, la separación entre las moléculas es mucho mayor que en los sólidos y líquidos. La fuerza de cohesión de las moléculas es muy pequeña, por lo que las mismas se mueven en todas las direcciones del espacio que ocupan.
El cambio de una sustancia del estado gaseoso al estado líquido se conoce con el nombre de condensación. Este proceso va acompañado de sustracción de energía del gas. Al quitar calor a una masa de vapor, su temperatura disminuirá y, cuando se alcance el valor que produjo la evaporación, el gas comenzara a condensarse. El punto de evaporación es igual al punto de condensación y el calor latente de condensación es igual al calor latente de vaporización.
La formación de pequeñas gotitas de agua en la superficie de una lata fría de refresco o en el parabrisas de un carro, son ejemplos de condensación. Las moléculas del vapor de agua chocan a alta velocidad con las moléculas más lentas y, por lo tanto, de menor energía, de la superficie fría. Las moléculas de vapor ceden energía y el vapor se condensa.
Las nubes y la neblina se originan por condensación del aire. Cuando el aire se calienta sube a las capas altas de la atmosfera; a medida que sube se expande y, como consecuencia, se enfría. Esto hace que las moléculas de vapor se agrupen, después de perder energía, al chocar entre sí. Este proceso continúa, el aire se condensa y se forman nubes; la neblina es una nube que se forma cerca de la superficie terrestre. Cuando el tamaño de las gotitas en la nube se incrementa, aumentan su peso, su velocidad y, entonces, se producen las lluvias.

Fuente
El vapor de agua siempre está presente en el aire, en mayor o menor cantidad. Hay, sin embargo, un límite a determinada temperatura. Cuando el aire alcanza este límite, se dice que está saturado. La humedad relativa del air indica la cantidad de vapor de agua, a una temperatura dada, en comparación con la cantidad de vapor cuando el aire está saturado. Cuando la humedad relativa es del 100%, el aire está saturado.
Referencias
Figuera, J. (2009). Física, Texto y problemario. Caracas: Ediciones CO-BO.
Figueroa, D. (2008). Fluidos y Termodinámica. Caracas: Douglas Figueroa.
Serway, R & Jewett, J. (2005). Física para Ciencias e Ingenierías, Volumen II. México: International Thomson Editores, S.A
Nota: Algunos de los diagramas y tablas presentados en esta publicación son diseñados y editados por mi persona utilizando elementos e imágenes del programa Microsoft Power Point, conjuntamente con la aplicaciòn Bitmoji.


0
0
0.000
https://twitter.com/ILovePhysica/status/1376653256890449929
https://twitter.com/ILovePhysica/status/1376653256890449929?s=20
Su post ha sido valorado por @ramonycajal
Saludos @hannymarchan, conocer los diferentes estados de la materia y las transiciones entre estos es muy importante para comprender muchos de los fenómenos naturales que observamos a diario.
Hola @emiliomoron muy acertado tu comentario... Es un tema que podemos ver a diario en la interacción con la naturaleza y pues con diversas aplicaciones medicas y científicas.
Gracias por visitar mi perfil y comentar.