Principio de Le Chatelier. Cambios en la concentración
Seguramente habrán notado que no es igual abrir una botella de refresco cuando el líquido está caliente que cuando esta frío; sabemos que la producción de gas es mucho mayor cuando el líquido está caliente, por lo que debemos abrirlo con cuidado ya que al romper el equilibrio interno entre el gas y la botella nos podemos llevar una sorpresa. Con este sencillo ejemplo nos podemos dar cuenta que existen diversos factores que pueden afectar un sistema que se encuentra en equilibrio, obligándolo a producir alguna respuesta a fin de compensar parcialmente el cambio mientras se establece una nueva condición de equilibrio.

Diversos factores afectan el equilibrio de una reacción. Fuente: @emiliomoron.
El principio de Le Chatelier es un principio empírico de la química que nos permite establecer cómo influyen diferentes factores sobre una reacción que se encuentra en equilibrio químico, y debido a que los equilibrios químicos son dinámicos responden a los cambios de las condiciones en las que se encuentra la reacción. Y aunque es un principio empírico que no ofrece una estimación cuantitativa, nos permite predecir en qué dirección de una reacción se desplazará el equilibrio para contrarrestar el efecto de dichos factores.
El principio establece que:
“Cuando se aplica un cambio a un sistema en equilibrio dinámico, el equilibrio tiende a ajustarse para reducir el efecto de ese cambio”[1].
Es decir, cuando el equilibrio de una reacción reversible es alterado por un cambio en las condiciones, su posición de equilibrio se desplazará para contrarrestar el cambio y restablecer el equilibrio. El cambio en las condiciones puede ser:
- Un cambio en la presión del sistema
- Un cambio de temperatura
- Un cambio de volumen
- Un cambio en la concentración de alguno de los reactivos o de los productos.
Debemos recordar que una reacción en equilibrio químico está constituida de dos reacciones que se producen simultáneamente en la que la concentración de reactivos y productos deja de variar en el tiempo, es decir, lo que se conoce como una reacción reversible. Un ejemplo es:
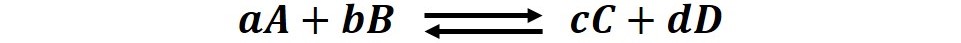
En esta reacción hipotética los reactivos A y B reaccionan para producir C y B (reacción directa), pero en cierto instante C y B reaccionan para producir nuevamente los reactivos (reacción inversa); y el equilibrio se alcanza cuando las velocidades de ambas reacciones se igualan y las concentraciones de cada especie permanecen constante.
Por lo que cuando ocurre alguno de los cambios descritos en alguna de las dos reacciones, la directa o la inversa, una se ve favorecida por la perturbación, por lo que el sistema responde tratando de reestablecer el equilibrio. Es como una balanza de las antiguas, de esas en las que se colocan masas en dos platos ubicados en los extremos de una barra. Si tenemos los platos en equilibrio y añadimos masa en un extremo (perturbamos el equilibrio), debemos añadir masa en el otro extremo para contrarrestar la perturbación y alcanzar un nuevo equilibrio.
Efecto del cambio de concentración
Vamos a analizar uno de los factores que pueden influir en la alteración de un equilibrio químico en base a lo planteado por el principio de Le Chatelier, en este caso analicemos que ocurre sobre el equilibrio al cambiar la concentración de una de las especies químicas presentes. Supongamos que tenemos la siguiente reacción en equilibrio:
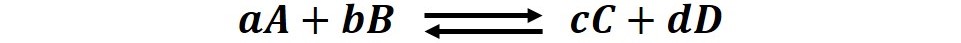
En la reacción tenemos cuatro especies químicas presentes, y de acuerdo al principio de Le Chatelier, si cambiamos la concentración de una de ellas, el sistema va a reaccionar para consumir el exceso añadido o para reponer la cantidad eliminada según sea el caso.
Por ejemplo, si perturbamos el equilibrio aumentando la concentración de A, el sistema reaccionara para consumir el incremento en la concentración de este, favoreciendo la reacción directa, porque así se consume A, y en consecuencia aumenta la concentración de los productos, es decir, decimos que el equilibrio se desplazó ahora hacia los productos, ya que la concentración de estos ahora es mayor con respecto a la condición inicial. Algo similar ocurriría si por ejemplo retiramos parte de C de la reacción, el sistema reacciona reponiendo parte de lo que se ha eliminado produciendo más C, favoreciendo la reacción directa y desplazando el equilibrio hacia los productos.
De forma análoga, si aumentamos la concentración de uno de los productos, el sistema responderá favoreciendo la reacción inversa, aumentando la concentración de los reactivos. Decimos entonces que el equilibrio se desplazó hacia la izquierda o hacia los reactivos, porque ahora su concentración es mayor con respecto a la condición inicial de equilibrio.
Experimento
Vamos a verificar lo predicho por el principio de Le Chatelier utilizando como ejemplo la reacción en equilibrio entre cromato de potasio y dicromato de potasio. Para ello vamos a disolver un poco de cromato de potasio en agua, al reaccionar con el agua se disocia en iones cromato, los cuales le otorgan a la solución una coloración amarilla.
Colocaremos unas 10 gotas de la solución de cromato de potasio en un tubo de ensayo y a continuación le agregaremos algunas gotas de ácido súlfurico concentrado. Podemos ver lo que ocurre en la siguiente imagen animada.

Desplazamiento del equilibrio de la reacción al añadir ácido súlfurico. Fuente: @emiliomoron.
Como podemos observar, al añadir el ácido súlfurico a la solución de cromato potasio, este reacciona de la siguiente forma:
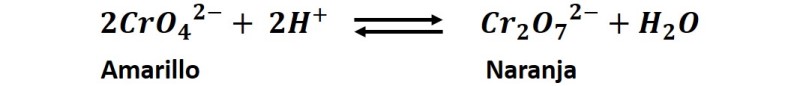
En este caso, al añadir el ácido a la solución, este se disocia aportando iones H+ a la reacción, incrementando la concentración de uno de los reactivos y en consecuencia favoreciendo la reacción directa y la producción de iones dicromato de color naranja.
Ahora veamos que ocurre si añadimos unas gotas de NaOH a la solución anterior.

Desplazamiento del equilibrio al añadir NaOH. Fuente: @emiliomoron.
En este caso podemos observar que al agregar el NaOH la solución se colorea nuevamente de color amarillo. Lo que ha ocurrido es que al añadir el NaOH este disocia aportando iones OH- a la solución, y estos neutralizan a los iones H+ produciendo agua. Por lo que ahora se está modificando la concentración de uno de los productos, así que el sistema responde favoreciendo la reacción inversa, regenerando los reactivos para consumir el exceso de agua presente, esto aumenta la concentración de iones cromato en la solución, volviéndola a colorear de amarillo.
Importancia del principio de Le Chatelier
Como podemos observar, si comprendemos bien cómo funciona este principio de la química, se puede manipular el estado de equilibrio de una reacción de acuerdo a nuestras necesidades; bien sea que nuestra intención sea favorecer la generación de productos para aumentar el rendimiento de una determinada reacción, añadiendo más reactivos si es que estos son económicos o retirando cantidades de producto a medida que se forman para mantener la posición de equilibrio favoreciendo esta dirección de la reacción.
Con esta demostración podemos observar cómo se puede modificar el estado de equilibrio de una reacción química según lo predicho por el principio de Le chatelier, que si bien es un principio empírico, es compatible con la termodinámica y nos permite obtener importantes conclusiones sobre cómo se verá influenciada una determinada reacción al modificar alguna de las condiciones del sistema.
Bueno amigos, espero les haya gustado el tema y la demostración de este principio. Hasta la próxima!
Referencias
Atkins, P., Jones, L. (2006). Principios de química. 3a edición, Médica Panamerica, Buenos Aires.
Has sido votado por
PROYECTO ENLACE
'Conectando Ideas y Comunidades'
PROYECTO ENLACE es un proyecto de curación de habla hispana enfocado en recompensar contenido de calidad y apoyar autores en su proceso de crecimiento en HIVE.
Creemos y apostamos por el futuro de esta gran plataforma, y estamos muy emocionados de poder hacerla crecer junto a esta comunidad. Así que te invitamos a usar nuestra etiqueta ENLACE y estar atento a todas las actividades que tenemos preparadas y que estaremos publicando en breve.
¿QUIERES AUTOMATIZAR TUS GANANCIAS DE CURACIÓN? SE PARTE DEL PROYECTO ENLACE APOYANDO A NUESTRO TRAIL EN HIVE.VOTE INGRESA AQUÍ PARA CONCOCER LOS DETALLES.
¿QUIERES INVERTIR ENLACE? DESCUBRE COMO HACERLO Y GENERAR INGRESOS DE FORMA SEMANAL MEDIANTE TU DELEGACIÓN DE HP AQUÍ TE EXPLICAMOS COMO.
Te invitamos a participar en nuestro servidor de Discord: https://discord.gg/3S9y7BbWfS
Atentamente
EQUIPO ENLACE 2021
Muchas gracias por el apoyo!
Your content has been voted as a part of Encouragement program. Keep up the good work!
Use Ecency daily to boost your growth on platform!
Support Ecency
Vote for Proposal
Delegate HP and earn more
Thank you very much for your support friends.
Hola @emiliomoron excelente presentación la que nos compartes... Me gusto bastante el ejemplo del refresco, es una situación de la cotidianidad que casi todos hemos experimentado pero que pocos sabemos de que se trata o como se llama.
Gracias por compartirnos este extraordinario contenido.
Saludos @hannymarchan, muchas gracias, me alegra que te haya gustado. En ese caso influyen la variación de la presión y la temperatura del sistema, quizás luego pueda continuar este tema ampliando la explicación a esos factores. Gracias por pasar a leer.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app app and including @stemsocial as a beneficiary to get a stronger support.
Muchas gracias por el apoyo amigos!